Validation d’une méthode ELISA de dosage de la progestérone plasmatique bovine, dans un objectif d’étalonnage d’un biocapteur électronique embarqué
Résumé
La démarche métrologique suivie pour développer une méthode d’analyse dans un laboratoire de recherche doit permettre de démontrer l’adéquation de ses performances au besoin analytique. L’objectif de ce travail a consisté à valider dans notre laboratoire une méthode d’analyse ELISA (Enzyme-Linked Immuno Sorbent Assay) de la progestérone plasmatique bovine, en qualité de méthode de référence. Les valeurs mesurées avec cette méthode d’analyse serviront de référence dans notre laboratoire pour étalonner un biocapteur électrochimique embarqué, développé dans le cadre du projet SmartRepro pour détecter les ovulations chez les vaches et permettre aux éleveurs de savoir à quel moment pratiquer l’insémination artificielle. Cette détection sera basée sur le prélèvement de fluides interstitiels et le monitoring des hormones impliquées dans la régulation du cycle ovarien et le déclenchement de l’ovulation, dont la progestérone. La démarche de validation de la méthode d’analyse pour ce projet a consisté à suivre deux étapes métrologiques : 1/ Vérifier sa conformité au regard de performances préconisées par la Food and Drug Administration (FDA) qui propose des limites d’acceptabilité de ± 30 % pour son exactitude, et 2/ Valider les performances de la méthode d’analyse au regard de l’objectif scientifique du projet SmartRepro. Cette démarche a permis d’obtenir le modèle de l’incertitude de mesure (IM) élargie suivant : U(Y) = 0,2004Y0.9684. Il a été démontré, en utilisant l’IM et le seuil de discrimination (SD) de la méthode, qu’elle était capable de décrire fidèlement l’évolution du taux de progestérone plasmatique. C’est cette capacité qui sera évaluée dans un 2e temps pour le biocapteur électronique embarqué, en prenant comme référence les valeurs obtenues par la méthode de dosage de la progestérone présentée dans cet article. De plus, les informations métrologiques obtenues permettront d’évaluer la capacité de cette méthode de référence à être utilisée dans de futurs projets de recherche.
Introduction
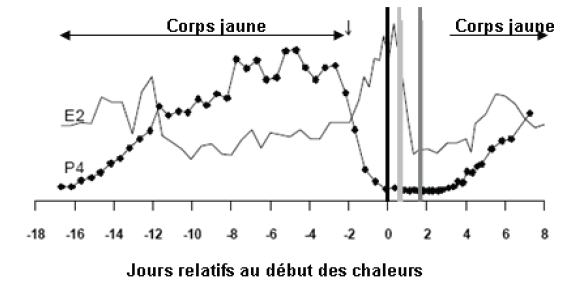
Ces dernières décennies, l’utilisation de l’insémination artificielle (IA) s’est très largement répandue en élevage laitier (en 2021 88 % des vaches laitières étaient inséminées en France ; Idele, 2022) pour deux raisons principales : assurer le progrès génétique et choisir le profil des jeunes produits (semence sexée pour le renouvellement du troupeau de femelles, semences issues de taureaux de race à viande pour la production de veaux croisés). L’utilisation de l’IA nécessite de repérer la période qui précède l’ovulation afin de pouvoir réaliser l’insémination au bon moment (Roelofs et al., 2004). En pratique, les éleveurs se basent sur la détection de l’œstrus, période d’une durée de 5 à 10 h (Cutullic, 2010) associée au pic d’œstradiol qui suit la lutéolyse et la chute de progestérone (Figure 1). Durant l’œstrus, les vaches interagissent plus fréquemment avec leurs congénères, expriment des comportements sexuels tels que des léchages et flairages au niveau de la vulve, des chevauchements et acceptations de chevauchements, ce qui se traduit par une augmentation de l’activité générale (Saint-Dizier, 2005 ; Disenhaus et al., 2010). L’œstrus se déroule dans les 25 à 30 h qui précédent l’ovulation (Cutullic, 2010) et lorsqu’il est détecté, l’IA est généralement réalisée dans les 12 à 24 h qui suivent. La détection de l’œstrus repose classiquement sur l’observation des comportements sexuels. Cependant, plusieurs études rendent compte d’une diminution de l’efficacité de cette détection pour plusieurs raisons : une diminution du temps que les éleveurs peuvent consacrer à l’observation de leurs animaux du fait d’une augmentation de la taille des troupeaux, une dégradation de l’expression des chaleurs (diminution de la durée des œstrus, moindre expression des acceptations de chevauchement) (Cutullic, 2010 ; Disenhaus et al., 2010), une augmentation de la proportion de vaches présentant des dysfonctionnements ovariens qui perturbent l’expression des chaleurs (Petersson et al., 2006 ; Cutullic et al., 2008). Pour aider les éleveurs à détecter les œstrus, plusieurs outils ont été développés et sont aujourd’hui commercialisés (Saint‐Dizier & Chastant‐Maillard, 2012). Certains sont dédiés à la détection des acceptations de chevauchement. D’autres enregistrent le niveau d’activité des animaux (déplacements, mouvements) et alertent l’éleveur lorsque ce niveau augmente de façon importante. Les premiers systèmes sont généralement peu coûteux mais à usage unique. Ce sont le plus souvent des patchs que l’on positionne sur la croupe des animaux et qui vont laisser une marque sous l’effet de la pression exercée par un congénère lors du chevauchement. Ces outils de détection sont très spécifiques car permettant de repérer les acceptations de chevauchement lorsqu’elles sont exprimées, mais ils ne permettent pas de repérer la totalité des œstrus dans la mesure où plus d’un tiers d’entre eux se déroulent sans expression d’acceptation de chevauchement chez les vaches laitières (Cutullic et al., 2006). Les outils de détection automatique des chaleurs basés sur l’enregistrement du niveau global d’activité des animaux sont plus sensibles que les précédents, mais moins spécifiques (beaucoup de faux positifs) (Saint-Dizier, 2005 ; Saint‐Dizier & Chastant‐Maillard, 2012), ce qui augmente le risque de fausses détections (déclarer des vaches en œstrus alors qu’elles ne le sont pas) et par conséquent le risque d’inséminer au mauvais moment. Afin de gagner en sensibilité et en spécificité, les recherches ont été orientées vers le développement d’outils basés sur le monitoring des hormones de la reproduction et plus particulièrement sur celui de la progestérone. C’est le cas de l’outil Herd Navigator™ qui dose la progestérone dans le lait (6 à 7 dosages par cycle sexuel) et déclenche une alerte lorsqu’il détecte une chute de progestérone en deçà de 4 ng.ml-1 (Saint‐Dizier & Chastant‐Maillard, 2012). Toutefois, ce système est relativement coûteux, il ne peut être utilisé que pour les animaux en lactation et ne peut être installé que dans certains types de salle de traite. Plus récemment, un partenariat a été constitué entre le CEA-Leti, INRAE et VetAgro Sup dans le cadre du projet SmartRepro afin de développer un dispositif microfluidique porté par l’animal, capable de doser à haute fréquence les hormones impliquées dans la régulation du cycle ovarien et le déclenchement de l’ovulation (progestérone, œstradiol et LH, Figure 1) à partir du prélèvement de fluides interstitiels au niveau du derme (Simon, 2021).
Figure 1. Représentation de l’évolution des concentrations plasmatiques de progestérone (P4), œstradiol (E2) et LH (trait vertical gris clair) au cours du cycle ovarien chez la vache laitière (unités arbitraires).
L’étude présentée ici porte sur le développement d’une méthode de dosage ELISA de la progestérone plasmatique chez la vache, devant servir de méthode de référence pour l’étalonnage d’un tel dispositif. Le biocapteur porté par l’animal sera un capteur électrochimique de type SG-FET Graphene (Simon, 2021) et devra être capable de décrire le plus fidèlement possible l’évolution de la concentration en progestérone dans les fluides interstitiels du derme, et notamment sa chute en fin de phase lutéale. L’évaluation de cette capacité sera réalisée en estimant la corrélation entre les concentrations de progestérone obtenues par le biocapteur et celles obtenues par la méthode de référence. Nous avons pour cela mis au point une méthode d’analyse ELISA de la progestérone dans le plasma bovin. Pour valider son utilisation en qualité de méthode de référence, il a été nécessaire de définir sa capacité à détecter un changement de valeur. Cette capacité conditionne son aptitude à décrire fidèlement l’évolution du taux de progestérone. Elle est estimée par son seuil de discrimination (SD) (Andanson et al., 2018 ; Andanson et al., 2019) calculé à partir de son incertitude de mesure (IM).
Après des rappels physiologiques (sur la progestérone plasmatique) et méthodologiques (sur la technique de dosage ELISA), cet article présente la démarche de validation de notre méthode de dosage de la progestérone dans le sang. Cette démarche a consisté en deux étapes métrologiques : 1/ Élaboration du profil d’exactitude (PE) de la méthode de dosage pour vérifier la conformité de ses performances par rapport aux exigences de la Food and Drug administration (FDA) et modéliser son IM ; 2/ Estimation du seuil de discrimination d’après l’IM pour définir la capacité de la méthode à décrire fidèlement l’évolution du taux de progestérone et la valider en qualité de méthode de référence dans notre laboratoire pour l’étalonnage futur du biocapteur.
Rappels physiologiques et méthodologiques
Profil de progestérone plasmatique chez la vache
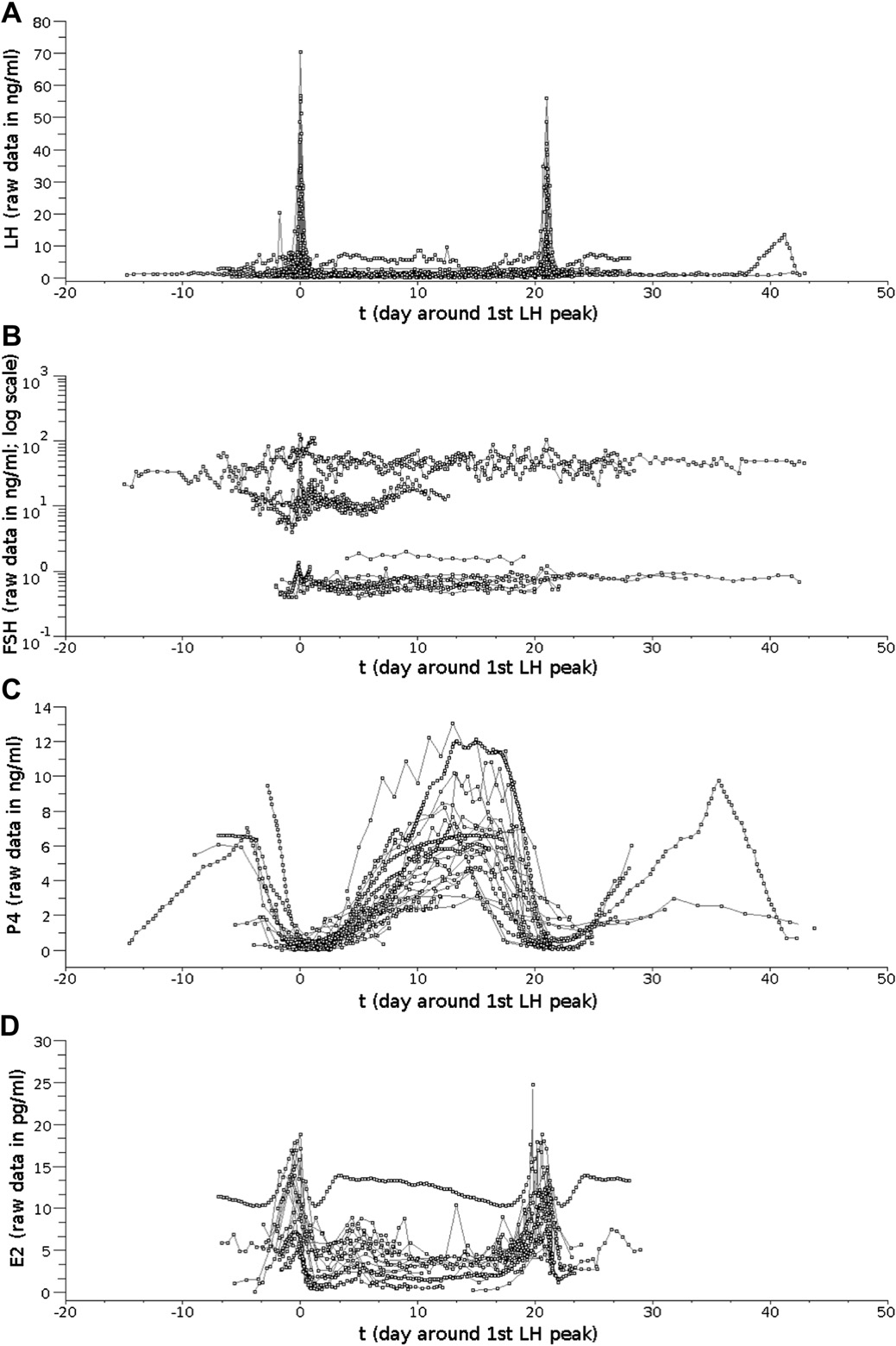
La progestérone est une hormone stéroïdienne impliquée dans la fonction de reproduction et synthétisée à partir du cholestérol sous l’action de la LH. Elle est synthétisée par les cellules lutéales du corps jaune, formé suite à l’ovulation du follicule dominant. Le corps jaune persiste durant toute la durée de la phase lutéale (de 17 à 18 jours chez la vache). Il sera lysé sous l’action des prostaglandines sécrétées par l’endomètre utérin en l’absence de fécondation, enclenchant ainsi une nouvelle phase folliculaire (de 3 à 4 jours chez la vache). Au contraire, en cas de fécondation, le corps jaune va se maintenir durant la gestation (Point, 2007). Pour un dosage donné, il est possible de définir un seuil de positivité permettant de distinguer le niveau de base observé durant la phase folliculaire du niveau observé durant la phase lutéale, mais ce seuil varie selon les dosages. Parmi les études basées sur les mesures de progestérone dans le plasma chez la vache, certaines suggèrent un seuil de positivité à 1 ng.ml-1 (Flores et al., 2006 ; Flores et al., 2007) et d’autres à 2 ng.ml-1 (Thimonier et al., 2000). La Figure 2 (Martin et al., 2012) illustre 20 profils d’évolution de la progestérone plasmatique au cours d’un cycle ovarien chez la vache, ainsi que la variabilité entre profils. Pour essayer de prédire le moment optimum pour l’insémination, il est nécessaire de pouvoir déterminer la baisse du taux de progestérone qui indique la fin de la phase lutéale et une potentielle venue en chaleur.
Figure 2. Évolution de la progestérone plasmatique au cours du cycle ovarien chez la vache (données de la littérature, n=20 profils de progestérone, d’après Martin et al. (2012).
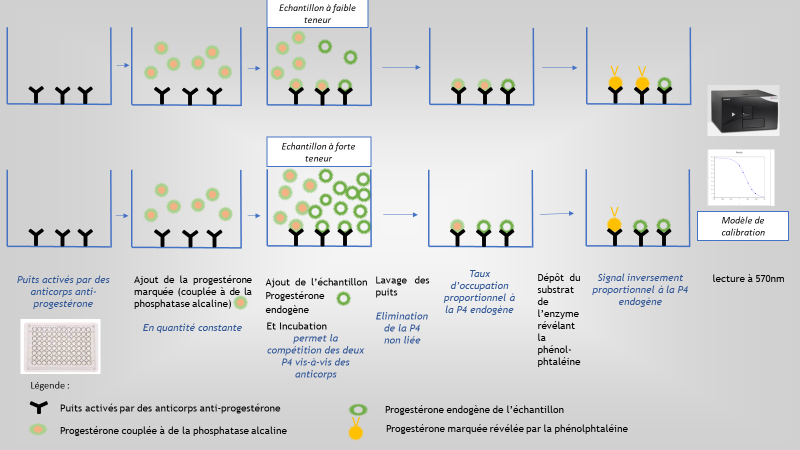
Principe analytique de la méthode d’analyse ELISA de la progestérone plasmatique bovine
La méthode d’analyse ELISA (Enzyme-Linked Immuno Sorbent Assay) est une technique de dosage d’immuno-absorption par une enzyme liée ou test immunologique qui permet la détection ou le dosage de molécules dans un échantillon biologique. Elle a été conceptualisée et développée par deux scientifiques suédois, Peter Perlmann et Eva Engvall à l’Université de Stockholm en 1971 (Engvall et al.,1971). Dans notre cas, le principe réactionnel du test repose sur la compétition entre la progestérone non marquée présente dans l’échantillon et le conjugué enzymatique (progestérone-PA : progestérone couplée à la phosphatase alcaline), pour un anticorps spécifique fixé sur la paroi des puits (Figure 3). Ce support permet ainsi de séparer la progestérone fixée de la progestérone libre restée en solution. Après incubation, les réactifs en excès (non fixés au fond des puits) sont éliminés par le lavage. La quantité de conjugué progestérone-PA fixée sur les puits est inversement proportionnelle à la concentration de progestérone non marquée présente dans l’échantillon. La progestérone-PA fixée est mesurée en faisant réagir la PA avec son substrat, le p-nitrophényl phosphate, lors d’une seconde incubation. La densité optique des puits est mesurée par spectrophotométrie et la concentration de progestérone dans l’échantillon est déterminée à partir d’une courbe-étalon.
Pour notre étude, nous avons utilisé des kits commercialisés par Ridgeway Research (Royaume-Uni) de référence « Progesterone ELISA Test Bovine (Serum/Plasma) ».
La gamme étalon fournie est composée de 7 points, 0, 0.5, 1, 2, 5, 10 et 20 ng.ml-1, dont l’amplitude encadre parfaitement les valeurs physiologiques des échantillons à analyser. Les valeurs de DO sont transformées en concentration avec un modèle de calcul non linéaire à 4 paramètres. La lecture des résultats est réalisée à 570 nm pour le plasma avec un spectrophotomètre pour microplaque de marque Tecan, modèle Infinite M200 série 709000574 (Tecan, Suisse) et du logiciel Magellan (version 6.6 1998-2009). Pour le rinçage des plaques, nous utilisons un laveur de plaque Biotek ELx50. Le tampon de lavage est un tampon phosphate à 1M à pH 7.4 préparé à partir d’une solution de di-potassium hydrogénophosphate (K2HPO4) à 1M, de potassium dihydrogénophosphate (KH2PO4) à 1M et gum de tween 20 (C58H11402). Ces réactifs de marque Merck sont achetés chez VWR (France).
Au moment du dosage, les échantillons de plasma sont décongelés à température ambiante, puis homogénéisés au vortex (cf. paragraphe : Origine et traitement des échantillons de plasma bovin).
Première étape de validation de la méthode de dosage : vérification de la conformité de la méthode par rapport aux exigences de la FDA d’après le profil d’exactitude
Un profil d’exactitude a été établi comme décrit dans Andanson et al. (2019). Pour cela, les feuilles de calcul Microsoft Excel®
(1)
Plan de validation utilisé pour le profil d’exactitude
Le plan de validation a été établi pour valider la méthode d’analyse de la progestérone plasmatique et comprenait :
● 3 séries de mesures réparties en 3 jours non consécutifs ;
● 3 répétitions par série ;
● 5 niveaux de concentration.
Échantillons de validation
Pour réaliser nos essais, nous ne disposions pas d’échantillons de validation de type MRC (matériel de référence certifié), qui représente la situation idéale pour valider une méthode d’analyse, ni de plasma déplété en progestérone avec lequel nous aurions pu créer des niveaux de concentration par ajouts dosés, qui est une solution alternative intéressante. Dans ces conditions et pour poursuivre notre étude, nous avons fait le choix d’utiliser un échantillon à teneur élevée (dont la valeur a été mesurée par un autre laboratoire) que nous avons dilué. Il a été obtenu dans le cadre d’une expérimentation antérieure sur l’étude du cycle de reproduction de vaches avec un régime alimentaire restreint. Des prélèvements sériés ont été réalisés pour cela et cet échantillon a été sélectionné pour notre étude car son taux de P4 était élevé et son volume suffisant pour réaliser nos essais. Cette approche permet de créer des niveaux de concentration, dont les intervalles représentent des repères fiables que l’on peut utiliser pour estimer la sensibilité de la méthode d’analyse (VIM, 2012 - §4.12). Nous avons réalisé les dilutions suivantes, 100 %, 75 %, 50 %, 25 %, 10 % avec de l’eau ultra pure pour obtenir un gradient de concentration décroissant. Chaque dilution a été réalisée indépendamment à partir d’un volume de plasma correspondant prélevé dans le pool de référence. Ainsi, ont été élaborées les concentrations nominales suivantes : 10.68, 8.01, 5.34, 2.67, 1.06 ng.ml-1. Cela a permis de couvrir la plage des valeurs physiologiques susceptibles d’être rencontrées chez la vache laitière et de collecter 45 données pour établir le profil d’exactitude (3 répétitions * 3 séries * 5 niveaux = 45 valeurs mesurées).
Profil d’exactitude et modélisation de l’incertitude de mesure
Cette première étape métrologique qui consiste à valider la méthode d’analyse d’après les exigences de la FDA a été réalisée après une phase de mise au point. Elle a consisté à identifier et à maîtriser les sources de variabilité liées aux étapes nécessaires à la mise en œuvre de la méthode d’analyse, de façon à disposer d’un mode opératoire optimisé et stabilisé.
Un premier profil d’exactitude a montré que la méthode d’analyse présente un biais négatif davantage exprimé pour les valeurs faibles (Figure 4). Pour que cette méthode soit rendue valide, il a fallu apporter un facteur de correction (comme décrit précédemment) qui est représenté dans la Figure 5. L’analyse de la modélisation de la sensibilité obtenue (Figure 5) a été réalisée comme décrit dans Andanson et al. (2018). Dans la fonction affine (Figure 5), qui représente le biais de mesure, la composante proportionnelle, dont la valeur est 1.038, soit très proche de 1, démontre que la méthode d’analyse ne présente pas de défaut de sensibilité sur tout le domaine de validation, ce qui pourrait avoir un impact au regard de l’objectif de notre étude. C’est en effet cette composante du biais de mesure, qui d’après la loi de propagation de l’erreur (GUM, 2008), influence la taille de l’IM et définit directement la capacité de la méthode d’analyse à discriminer, c’est-à-dire dans notre situation, à détecter un changement du taux de progestérone. Il est également estimé une composante constante dans le biais de mesure, dont la valeur est -0.3992 ng.ml-1, son expression est davantage rendue visible sur le profil d’exactitude au niveau des faibles teneurs car l’exactitude est représentée en pourcentage. Nous avons choisi de la corriger de façon à ce que l’exactitude de nos valeurs soit conforme aux exigences de la FDA. Elle est sans effet sur l’objectif de l’étude, car elle n’intervient pas dans la capacité à discriminer des valeurs mesurées par la méthode d’analyse. Elle induit uniquement un décalage systématique des valeurs mesurées que nous compensons avec un facteur de correction, c’est-à-dire l’ajout de 0.4 ng.ml-1 à ces valeurs. En chimie analytique, elle est définie par le terme de « blanc » et son origine comme proposé dans Andanson et al. (2018) est souvent multiple : blanc réactif, concentration endogène, interférence, etc. Ainsi un nouveau profil d’exactitude a été recalculé (Figure 6) ce qui permet de rendre la méthode valide. Désormais, toutes les mesures obtenues par cette méthode seront corrigées par ce facteur, c’est-à-dire que leur valeur sera systématiquement augmentée de 0.4 ng.ml-1 afin d’obtenir une détermination plus exacte de la concentration de progestérone dans le plasma. Pour notre méthode, le domaine de validité de la concentration plasmatique de progestérone chez la vache laitière est compris entre 1.11 ng.ml-1 et 11.1 ng.ml-1.
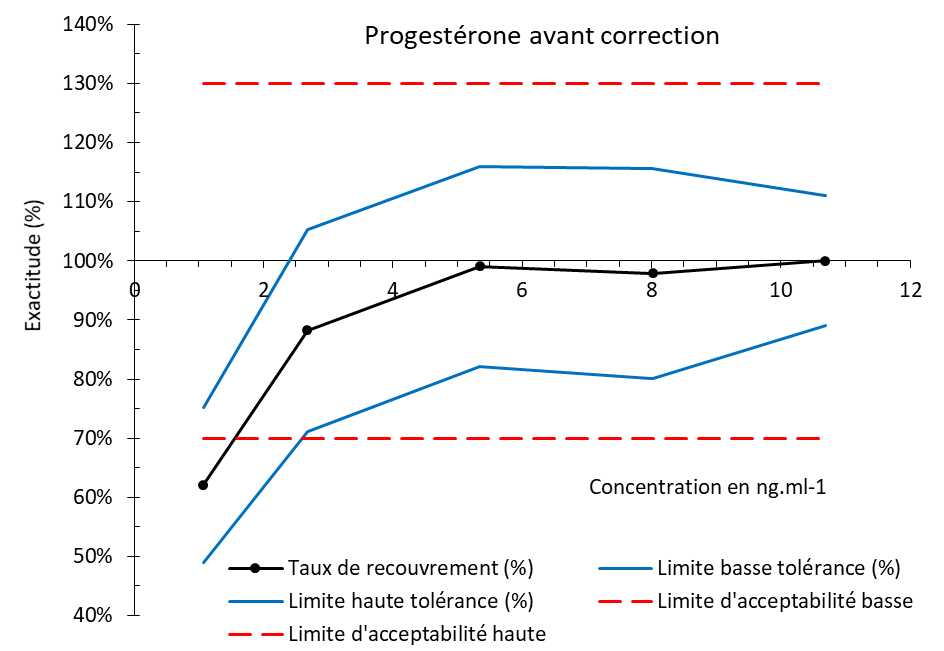
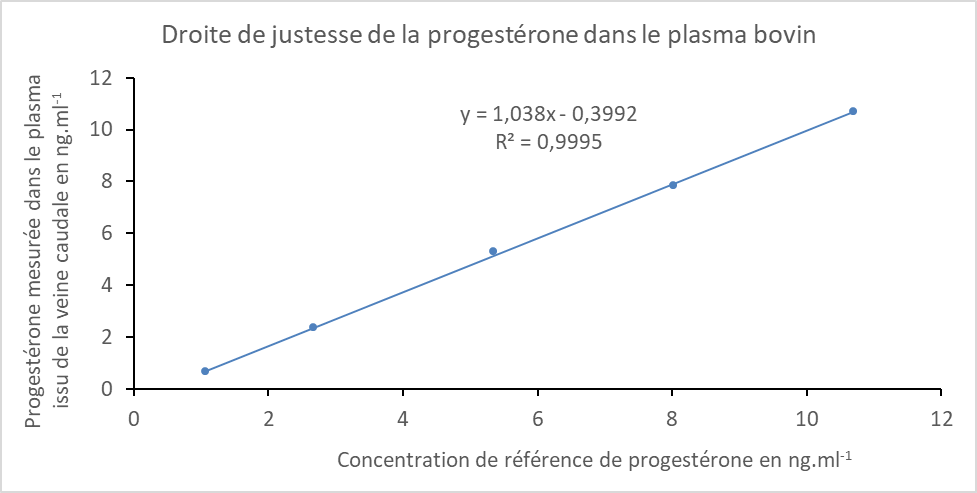
Figure 6. Profil d’exactitude de la méthode d’analyse ELISA de la progestérone plasmatique après correction
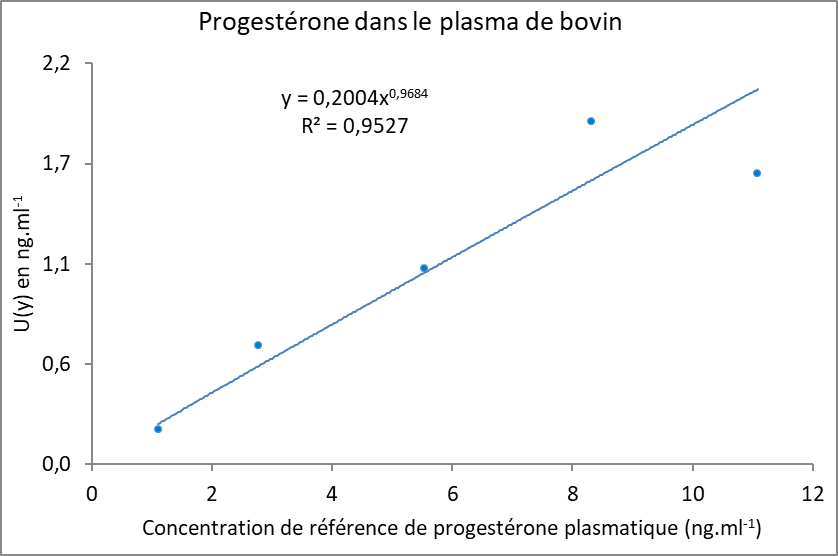
La fonction d’incertitude élargie a été obtenue à partir des résultats du profil d’exactitude corrigé (Figure 6). Cette fonction relie l’incertitude de mesure et la concentration en progestérone, et permet de déterminer le SD (Figures 6 et 7). Selon la notation proposée, Y représente la concentration de progestérone plasmatique mesurée en ng.ml-1 et U(Y) son incertitude élargie :
(2)
L’estimation de l’IM pourrait cependant être améliorée à l’avenir, d’une part en ajoutant au profil d’exactitude des échantillons de validation ayant des concentrations supérieures au dernier point proposé de 11.1 ng.ml-1, afin d’élargir le domaine de validation. En effet, après les essais de validation de la méthode, des échantillons de plasma avec des concentrations en progestérone supérieures à 11.1 ng.ml-1 ont été analysés, ce qui nécessite de mieux estimer l’IM. D’autre part, d’autres sources d’incertitude pourraient être intégrées à son estimation telles que l’IM de l’échantillon de référence, celles liées aux échantillons de validation dont les étapes de dilution nécessaires à leur préparation sont des sources de variabilité et l’IM du facteur de correction.
Cette première étape a montré que la méthode d’analyse est validée d’après les exigences de la FDA. Il a été nécessaire pour cela de réaliser deux profils d’exactitude.
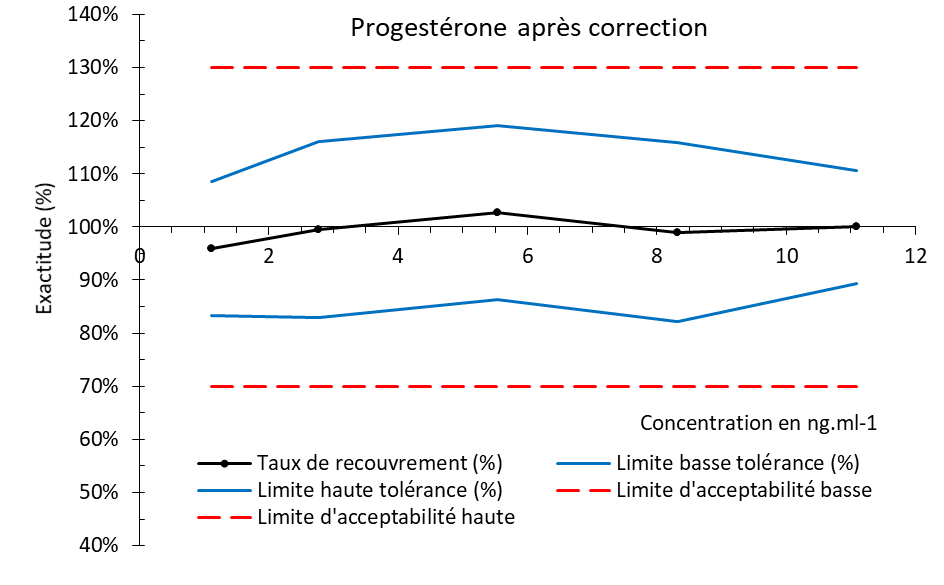
Seconde étape : validation de la méthode de dosage en tant que méthode de référence pour étalonner le biocapteur
Il s’agissait d’évaluer la capacité de la méthode d’analyse à décrire fidèlement l’évolution du taux de progestérone plasmatique afin que les valeurs mesurées puissent servir de référence pour l’étalonnage du biocapteur. Pour cela le seuil de discrimination de la méthode d’analyse a été estimé à partir de l’analyse d’échantillons de plasma obtenus lors des phases lutéale et folliculaire du cycle ovarien (cf. paragraphe : Origine et traitement des échantillons de plasma bovin). Ce critère permet d’évaluer la fiabilité de la méthode d’analyse à détecter cette transition entre phases du cycle ovarien et de la valider en qualité de méthode de référence.
Seuil de discrimination (SD) de la méthode d’analyse
Le SD est défini comme « la plus grande variation d’une valeur mesurée d’une grandeur qui n’entraîne aucun changement détectable de l’indication correspondante » (VIM, 2012 - §4.16). Il correspond à la plus grande variation de cette grandeur non détectable par une méthode d’analyse. Il est utilisé dans l’étude pour valider la méthode d’analyse de la progestérone dans le plasma pour estimer sa capacité à détecter les changements naturels des taux de progestérone lors d’un cycle ovarien.
Afin de l’estimer, nous avons utilisé la formule de calcul proposée par Andanson et al. (2019).
(3)
Cy correspond au changement du taux de progestérone entre Yinit la teneur initiale, et Yfin la teneur finale. Noté :
(4)
U(Cy) représente l’incertitude élargie à 95 % de l’IM de la valeur de ce changement de concentration, obtenue d’après :
(5)
Les valeurs des incertitudes types composées uc(Yfin) et uc(Yinit) sont obtenues à partir des feuilles de calcul de l’outil Excel® du profil d’exactitude1 à l’onglet bilan à partir de leur incertitude élargie.
La méthode d’analyse de la progestérone dans le plasma détectera un changement de concentration entre Yinit et Yfin lorsque :
(6)
Origine et traitement des échantillons de plasma bovin
De façon à disposer d’échantillons plasmatiques permettant de décrire l’évolution de la progestérone pendant les phases lutéale et folliculaire du cycle ovarien, des prélèvements sanguins sériés ont été réalisés sur 10 vaches multipares de race Holstein. L’ensemble des procédures expérimentales a été réalisé en accord avec la directive européenne 2010/63/EU sur la protection d’animaux utilisés à des fins scientifiques et approuvé par le ministère français de l’Enseignement supérieur, de la Recherche et de l’Innovation après avis favorable du comité d’éthique en expérimentation animale local (protocole référencé sous le numéro APAFIS #15401-2017062616304407 v5). Quarante-huit jours après vêlage, un traitement hormonal d’induction de l’ovulation a été appliqué afin de contrôler le début des cycles ovariens (protocole PRID® Delta + PMSG (Med’Vet 2021) : pose du PRID® Delta 1,55 g Système de diffusion vaginal pour bovins (Ceva Santé animale, France) à J-7, injection de prostaglandines (PGF2) à J-1 SYNCROPROST 0,250 mg/ml solution injectable pour bovins, chevaux, porcins et chèvres (Ceva Santé animale, France, retrait du PRID® Delta à J0, injection de PMSG à J0 SYNCRO-PART® PMSG 500 UI Vaches laitières (Ceva Santé animale, France)). Des prélèvements de sang sériés ont été réalisés toutes les 4 à 6 heures pendant 10 jours entre 7h30 et 21h00. Ils ont commencé 2 jours avant le retrait du PRID® DELTA (J-2) à 7h30 (T0). Le sang a été prélevé par ponction à la veine caudale avec des tubes de 9 ml contenant de l’héparine de sodium (Greiner Vacutest VK109SH 9ml (Labelians, France)).
Le plasma a été séparé par centrifugation à 3000 g pendant 20 min à +4°C, et a ensuite été distribué dans des microtubes de 500 ul qui ont été congelés à -20°C.
Les échantillons de sang d’une vache ayant bien répondu au traitement hormonal ont été sélectionnés pour valider la méthode de dosage.
Utilisation de l’incertitude de mesure (IM) et du seuil de discrimination (SD) de la méthode d’analyse pour valider sa capacité à décrire l’évolution du taux de progestérone plasmatique
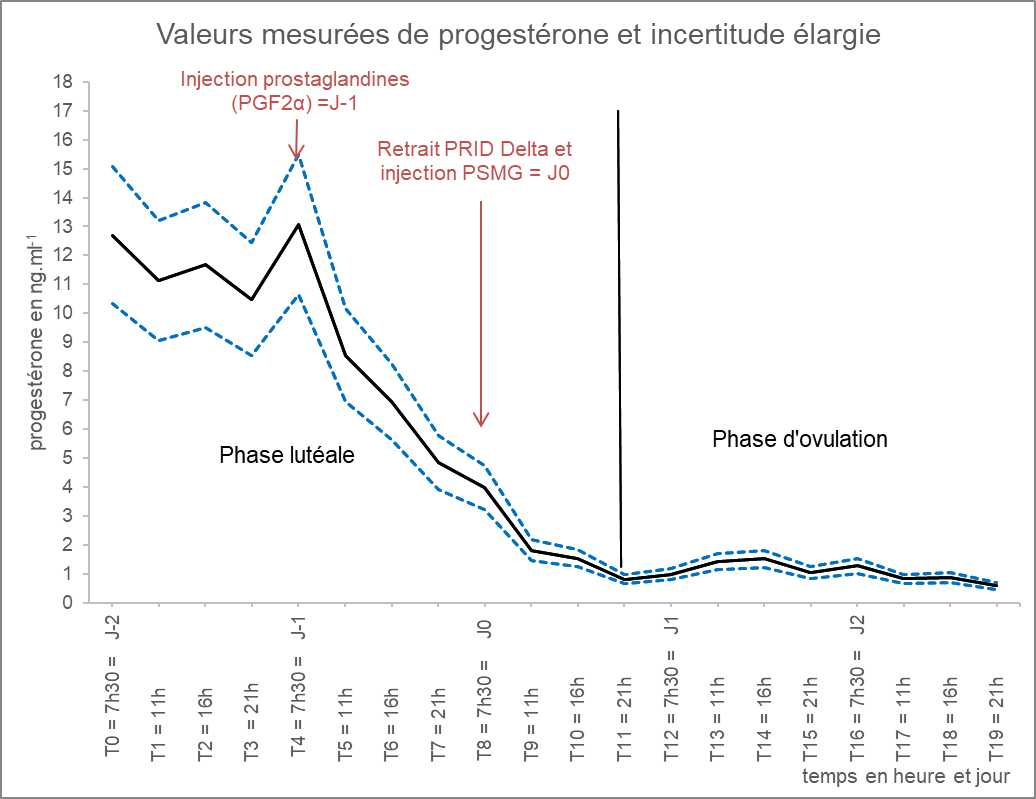
La seconde étape métrologique démontre l’adéquation des performances de la méthode de dosage de la progestérone au besoin de l’étude. Pour la vache étudiée, les IM des valeurs de concentration en progestérone mesurées au cours du cycle ovarien (en fin de phase lutéale puis en phase folliculaire) ont été estimées d’après la formule (2) et sont reportées sur la Figure 8 afin de matérialiser l’incertitude élargie à l’intérieur de laquelle se trouvent les valeurs mesurées de progestérone avec une probabilité associée de 95 %. Cette représentation démontre visuellement que la méthode de dosage permet de suivre objectivement les changements du taux de progestérone plasmatique pour un individu donné. Le profil de progestérone plasmatique décrit par notre méthode en fin de phase lutéale et en phase folliculaire est cohérent, tant du point de vue des concentrations mesurées que de l’amplitude de leurs variations, avec ceux décrits dans la littérature (Martin et al., 2012).
En outre, le SD calculé d’après l’IM (Tableau 1), apporte une validation statistique à la capacité de la méthode à décrire précisément le phénomène étudié, en démontrant sa capacité à détecter significativement de faibles changements du taux de progestérone. Cet exemple montre que le SD est inférieur dans de nombreux cas à la valeur des changements observés, ce qui permet un suivi pertinent de l’évolution du taux de progestérone (dernière colonne du Tableau 1). Ceci peut se traduire en situation réelle par le fait qu’il suffit de très peu de temps dans l’avancement du cycle ovarien pour percevoir un changement du taux de progestérone. Cette capacité fait de la méthode de dosage validée un outil efficace pour détecter précocement un changement dans le profil hormonal.
Figure 8. Profil de progestérone plasmatique, en ng.ml-1 d’une vache laitière, déterminé par la méthode de dosage ELISA développée dans l’étude
Chronologie des prélèvements (heures) de J-2 (7h30 = T0) à J3 | Progestérone plasmatique ng.ml-1 | uc(y) | SD | Différence absolue en ng.ml-1 (par rapport à la valeur de la ligne précédente) | Discrimination possible ? (Par rapport à la valeur de la ligne précédente) |
T0 = 7h30 = J-2 | 12.70 | 0.59 | . | . | . |
T1 = 11h | 11.15 | 0.52 | 1.57 | 1.56 | non |
T2 = 16h | 11.68 | 0.54 | 1.50 | 0.53 | non |
T3 = 21h | 10.50 | 0.49 | 1.46 | 1.18 | non |
T4 = 7h30 = J-1 | 13.06 | 0.60 | 1.55 | 2.56 | oui |
T5 = 11h | 8.56 | 0.40 | 1.45 | 4.50 | oui |
T6 = 16h | 6.96 | 0.33 | 1.04 | 1.60 | oui |
T7 = 21h | 4.87 | 0.23 | 0.80 | 2.09 | oui |
T8 = 7h30 = J0 | 3.99 | 0.19 | 0.60 | 0.88 | oui |
T9 = 11h | 1.83 | 0.09 | 0.42 | 2.16 | oui |
T10 = 16h | 1.56 | 0.08 | 0.24 | 0.27 | oui |
T11 = 21h | 0.84 | 0.04 | 0.18 | 0.73 | oui |
T12 = 7h30 = J1 | 1.00 | 0.05 | 0.13 | 0.17 | oui |
T13 = 11h | 1.44 | 0.07 | 0.17 | 0.44 | oui |
T14 = 16h | 1.53 | 0.08 | 0.21 | 0.09 | non |
T15 = 21h | 1.07 | 0.05 | 0.19 | 0.46 | oui |
T16 = 7h30 = J2 | 1.29 | 0.06 | 0.17 | 0.22 | oui |
T17 = 11h | 0.84 | 0.04 | 0.15 | 0.45 | oui |
T18 = 16h | 0.88 | 0.04 | 0.12 | 0.04 | non |
T19 = 21h | 0.61 | 0.03 | 0.11 | 0.27 | oui |
Conclusion
L’objectif de cette étude était de valider notre méthode de dosage ELISA de la progestérone plasmatique bovine en qualité de méthode de référence dans notre laboratoire pour étalonner un biocapteur électronique embarqué qui devrait permettre de quantifier la progestérone en continu chez la vache.
Dans notre démarche de validation, la première étape métrologique a eu une double utilité. Elle a permis de démontrer que notre méthode de dosage est conforme sur le plan de son erreur de mesure aux exigences de la FDA. Puis elle a permis de modéliser son IM qui est utilisée pour la seconde étape métrologique. Pour cela, la réalisation d’un profil d’exactitude a permis de visualiser graphiquement que les performances de la méthode de dosage sont conformes à celles qui font consensus sur le plan international pour cette famille de méthodes biochimiques. C’est une vérification de conformité. Elle correspond à un raccordement métrologique qui garantit que le laboratoire dispose d’un système de mesure fonctionnel, dont les performances sont équivalentes aux systèmes de mesure similaires utilisés dans d’autres laboratoires. La modélisation de l’IM est réalisée automatiquement lors de l’élaboration du profil d’exactitude avec l’outil Excel mis à disposition à INRAE1.
Nous avons également comparé les performances de notre méthode, sur le plan de l’incertitude de mesure, avec deux méthodes d’analyse ELISA développées à INRAE (Canepa et al., 2008 ; Laclie et al., 2022). Pour réaliser cette comparaison, nous avons estimé l’incertitude de mesure élargie de ces deux méthodes à partir des informations publiées. Dans le premier article, la méthode d’analyse est validée de 0.4 ng.ml-1 à 10 ng.ml-1 et la dispersion des valeurs est exprimée en CV % dans des conditions de répétabilité. Elle est observée à 10 % sur le domaine de validité, ce qui correspond, exprimée en valeur d’incertitude élargie, à 20 % avec un coefficient d’élargissement k=2. Dans le second article, la dispersion dans des conditions de reproductibilité est estimée sous la forme de SEM (standard error of the mean) qui d’après les données disponibles permet de revenir à une incertitude élargie de 46 % pour une valeur de contrôle à 1.3 ng.ml-1. D’après l’estimation de l’incertitude élargie de notre méthode d’analyse, pour cette même valeur de contrôle il est obtenu 9,2 %. Cette comparaison nous permet également de vérifier que la performance de notre méthode d’analyse en matière de dispersion est acceptable.
La seconde étape métrologique a permis de valider la méthode de dosages en qualité de méthode de référence dans notre laboratoire pour étalonner le futur biocapteur. Le SD estimé dans l’étude, pendant la fin de phase lutéale et la phase folliculaire d’une vache laitière, a démontré la capacité de la méthode à décrire fidèlement l’évolution du taux de progestérone plasmatique. Cette méthode d’analyse permet une description suffisamment fiable du profil de progestérone plasmatique pendant le cycle ovarien, ce qui permet de répondre à l’objectif scientifique du projet SmartRepro : valider le futur biocapteur par comparaison à notre méthode d’analyse de référence.
Perspectives pour de futurs projets de recherche
Cette méthode d’analyse de la progestérone, dont le coût de mise en œuvre est très faible, permettra de disposer dans notre laboratoire d’un outil analytique supplémentaire pour les projets de recherche futurs. Au-delà de cette étude, la validation par le profil d’exactitude permettra d’exprimer les futures valeurs mesurées sous la forme de résultats de mesure (VIM, 2012 - §2.9), c’est-à-dire en y associant l’information concernant le biais de mesure et les IM correspondantes qui sont les composantes de l’erreur de mesure. Ces informations permettront de prendre des décisions dès la conception des expérimentations. Il sera possible de faire appel ou non à la méthode d’analyse d’après son adéquation aux objectifs analytiques des études, notamment en calculant rapidement les IM des valeurs de progestérone qui seront potentiellement obtenues et le SD correspondant dans le cas où des changements de valeurs seraient à observer. Le calcul du SD permettra également d’optimiser les schémas expérimentaux en calculant avant les expérimentations l’effectif minimal « n » d’animaux à utiliser pour annuler l’effet de l’erreur de mesure de la méthode d’analyse (Andanson et al., 2018 ; Andanson et al., 2019 ; Alvarez et al., 2021).
Remerciements
Les auteurs remercient le comité de pilotage du réseau M³ INRAE* (pôle Management par la qualité, UAR1412 INRAE DIAGONAL), représenté par Stéphane Andanson qui a accepté d’accompagner la présente étude et apporté son expertise en validation des méthodes d’analyse dans l’objectif de fiabiliser les résultats de la recherche conformément à la politique qualité INRAE 2023-2027.
* Réseau d’experts-métiers à INRAE dans le domaine de la mesure, la métrologie et la validation des méthodes d’analyse
Notes
- 1. Téléchargeable sur https://intranet.inrae.fr/qualite/Outils/Mesure-Metrologie-et-validation-de-Methodes
- 2. https://novae.hub.inrae.fr/les-articles-parus/les-numeros-speciaux/validation-des-methodes
Références
- Alvarez, D., Andanson, S., Perrochon, S., Le Gouis, J., Ravel, C. (2021). Validation de la méthode de quantification de l’azote par analyseur élémentaire méthode Dumas et détermination des conditions d’utilisation d’après son incertitude de mesure et son seuil de discrimination. Cahier des techniques de l’INRA, 105, 1-20. https://hal.science/hal-03184227
- Andanson, S., Veissier, I., Feinberg, M. H. (2018). The discrimination threshold: A selection criterion for analytical methods based on measurement uncertainty – Application to animal stress studies. Analytica Chimica Acta, 1020, 9-16. https://doi.org/10.1016/j.aca.2018.03.032
- Andanson, S., Delahaye, Q., Ravel, C., Feinberg M. (2019). De nouveaux critères de sélection des méthodes quantitatives d’analyses fondés sur l’incertitude de mesure : Application à une méthode HPLC d’analyse des catécholamines. Cahier des techniques de l’INRA, 96, 1-19. https://hal.science/hal-02192513
- Canepa, S., Lainé, A.-L., Bluteau, A., Fagu, C., Flon, C., Monniaux, D. (2008). Validation d’une méthode immunoenzymatique pour le dosage de la progestérone dans le plasma des ovins et des bovins. Cahier des techniques de l’INRA, 64, 19-30. https://hal.inrae.fr/hal-02667281
- Cutullic, E., Delaby, L., Causeur, G., Disenhaus, C. (2006). Facteurs de variation de la détection des chaleurs chez la vache laitière conduite en vêlages groupés. Rencontres Recherche Ruminants, 13, 269-272. https://idele.fr/fileadmin/medias/Documents/18_Paccard2009.pdf
- Cutullic, E., Delaby, L., Causeur, D., Michel, G., Disenhaus, C. (2008). Hierarchy of factors affecting behavioural signs used for oestrus detection of Holstein and Normande dairy cows in a seasonal calving system. Animal Reproduction Science, 113(1 4), 22 37. https://doi.org/10.1016/j.anireprosci.2008.07.001
- Cutullic, E. (2010). Concurrence entre lactation et reproduction chez la vache laitière : [thèse soutenue sur un ensemble de travaux]. Theses.fr. https://theses.fr/2010CAEN2007
- Disenhaus, C., Cutullic, E., Freret, S., Paccard, P., Ponsart C. (2010). Vers une cohérence des pratiques de détection des chaleurs : intégrer la vache, l’éleveur et le système d’élevage. Rencontres Recherches Ruminants, 17, 113-120. https://www.researchgate.net/publication/280045354
- Engvall, E., & Perlmann, P. (1971). Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobulin G. Immunochemistry, 8(9), 871 874. https://doi.org/10.1016/0019-2791(71)90454-x
- FDA (2018). Bioanalytical Method Validation. Guidance for Industry. https://www.fda.gov/files/drugs/published/Bioanalytical-Method-Validation-Guidance-for-Industry.pdf
- Feinberg, M. (2009). Guide de validation des méthodes analytiques. Dans Labo-Stat. Éditions Tec & Doc et Lavoisier
- Feinberg, M. (2010). Principes et vocabulaire pour la validation des méthodes. Cahier des techniques de l’INRA, numéro spécial, 13-25. https://hal.inrae.fr/hal-04701386
- Flores, R., Looper, M. L., Kreider, D. L., Post, N. M., Rosenkrans, C. F. (2006). Estrous behavior and initiation of estrous cycles in postpartum Brahman-influenced cows after treatment with progesterone and prostaglandin F2α1,2. Journal Of Animal Science, 84(7), 1916 1925. https://doi.org/10.2527/jas.2005-692
- Flores, R., Looper, M. L., Rorie, R. W., Lamb, M. A., Reiter, S. T., Hallford, D. M., Kreider, D. L., Rosenkrans, C. F. (2007). Influence of body condition and bovine somatotropin on estrous behavior, reproductive performance, and concentrations of serum somatotropin and plasma fatty acids in postpartum Brahman-influenced cows1,2. Journal Of Animal Science, 85(5), 1318 1329. https://doi.org/10.2527/jas.2006-606
- GUM, Guide to the Expression of Uncertainty in Measurement (2008). Evaluation of Measurement Data, 100. Bureau international des poids et mesures. http://www.bipm.org/utils/common/documents/jcgm/JCGM_100_2008_E.pdf (dernier accès 11-17-2017)
- Idele (2022). Statistiques générales de l’inséminations sur femelles laitières Campagne IA 2020-2021. (2022, 9 juillet). Institut de L’Élevage. https://idele.fr/detail-article/statistiques-generales-de-linseminations-sur-femelles-laitieres-campagne-ia-2020-2021
- Laclie, C., Gennetay, D., Gaudet, M., Lainé, A. (2022). Coupling steroids with alkaline phosphatase for competitive immunoenzymatic assays in the plasma of various domestic mammals. Novae. https://doi.org/10.17180/novae-2022-no-art04
- Martin, O., Friggens, N., Dupont, J., Salvetti, P., Freret, S., Rame, C., Elis, S., Gatien, J., Disenhaus, C., Blanc, F. (2012). Data-derived reference profiles with corepresentation of progesterone, estradiol, LH, and FSH dynamics during the bovine estrous cycle. Theriogenology, 79(2), 331-343.e4. https://doi.org/10.1016/j.theriogenology.2012.09.025
- Petersson, K., Gustafsson, H., Strandberg, E., Berglund, B. (2006). Atypical Progesterone Profiles and Fertility in Swedish Dairy Cows. Journal Of Dairy Science, 89(7), 2529 2538. https://doi.org/10.3168/jds.s0022-0302(06)72328-1
- Point, F. (2007). Contribution à l’étude de la détection des chaleurs par vidéosurveillance chez la vache laitière. Comparaison avec les profils de progestérone. [Thèse vétérinaire, Université Claude Bernard Lyon 1]. Theses.fr. https://www2.vetagro-sup.fr/bib/fondoc/th_sout/th_pdf/2007lyon075.pdf
- Roelofs, J., Van Eerdenburg, F., Soede, N., Kemp, B. (2004). Various behavioral signs of estrous and their relationship with time of ovulation in dairy cattle. Theriogenology, 63(5), 1366 1377. https://doi.org/10.1016/j.theriogenology.2004.07.009
- Saint-Dizier, M. (2005). La détection des chaleurs chez la vache. Le Point Vétérinaire/Reproduction des Ruminants : maîtrise des cycles et pathologie. 22-27.
- Saint‐Dizier, M. & Chastant‐Maillard, S. (2012). Towards an Automated Detection of Oestrus in Dairy Cattle. Reproduction In Domestic Animals, 47(6), 1056 1061. https://doi.org/10.1111/j.1439-0531.2011.01971.x
- Simon, J. (2021). Développement d’un outil embarqué de détection des ovulations chez les bovins : de la définition d’un système de microaiguilles pour prélever les fluides interstitiels, au développement d’un aptasensor. Theses.fr. https://theses.fr/2021GRALI102
- Thimonier, J. (2000). Détermination de l’état physiologique des femelles par analyse des niveaux de progestérone. INRAE Productions Animales, 13(3), 177 183. https://doi.org/10.20870/productions-animales.2000.13.3.3779
- VIM (2012). Vocabulaire international de métrologie, 200, 3e édition. Bureau international des poids et mesures. http://www.bipm.org/utils/common/documents/jcgm/JCGM_200_2012.pdf (dernier accès 11-17-2017)
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 688
Vues: 688
Téléchargements
 PDF: 179
PDF: 179

