Optimisation de la technique de coupe au microtome à l’aide d’un vernis
Résumé
L’histologie, quelle que soit sa forme, est très utilisée pour l’étude des tissus et des cellules qui composent le monde du vivant. La technique de la résine méthacrylate, très utilisée en laboratoire, présente un inconvénient majeur lors de la coupe de tissus très structurés et fragiles : les échantillons se déchirent facilement. Pour y remédier, l’utilisation d’une résine transparente de type vernis s’avère être une solution efficace. Ce vernis aide à maintenir les structures tissulaires entières et intactes, évitant ainsi leur déchirement et leur déstructuration lors de la coupe. Le procédé est relativement simple : il consiste à appliquer une fine couche de vernis sur la surface du bloc, puis à laisser sécher cette couche avant la coupe. Une fois la coupe réalisée, elle est soigneusement récupérée et déposée sur une surface d’eau chaude à 60 °C. Sous l’effet de la chaleur, la coupe se déploie facilitant son transfert sur une lame de microscope en verre. Cette lame est ensuite séchée sur une plaque chauffante avant d’être colorée, ce qui permet de mettre en évidence les structures tissulaires lors de l’observation microscopique. Ce geste, bien que simple, résout un problème majeur rencontré lors de la coupe de tissus complexes et fragiles, améliorant considérablement la précision des analyses histologiques.
Introduction
L’obtention de coupes histologiques de bonne qualité est essentielle pour bien décrire et comprendre l’organisation des tissus végétaux. Ces coupes permettent d’analyser la structure cellulaire et tissulaire, ce qui est crucial pour les études en botanique, en agronomie et en biologie.
Dans un premier temps, les échantillons doivent être inclus dans une résine méthacrylate après avoir subi plusieurs étapes préliminaires, telles que la déshydratation, l’imbibition et l’imprégnation. Seule la coupe au microtome permettra de savoir si les échantillons sont parfaitement inclus.
Lors du passage du bloc de résine sur le couteau du microtome, il arrive que l’échantillon se déchire, ce qui compromet la qualité des coupes et par suite l’interprétation précise des résultats. Ce problème est particulièrement fréquent avec des tissus complexes et fragiles, qui nécessitent une manipulation délicate.
Lorsque les organes se plient sans se déchirer, il est possible de corriger cette déformation en réajustant les sections avec une pointe métallique ou avec une « moustache de chat » fixée à une pipette Pasteur. Cette technique, bien que relativement efficace, présente des limites significatives. En effet, elle devient difficile à appliquer pour les échantillons fragiles, délicats ou complexes tels que les organes floraux, les tiges et les feuilles de riz. Dans ce cas, le risque est grand de compromettre l’intégrité des échantillons. L’altération des échantillons au cours de la coupe entraine une perte considérable des informations anatomiques et biochimiques, ce qui rend l’analyse histologique plus difficile.
Pour remédier à cette situation, nous avons mis en place un procédé relativement simple mais efficace. Il consiste à appliquer d’une fine couche d’un produit de type « vernis à ongle transparent » sur la surface du bloc. Ce vernis aide à maintenir les structures tissulaires intactes et solidaires entre elles, évitant ainsi le déchirement des coupes.
Cet article présente cette technique ainsi que son application sur les organes de palmiers et de riz.
Rappel du protocole d’inclusion en résine
Le protocole d'histologie (Manuel Technique d’Histologie et d’Imagerie Cellulaire - CIRAD) commence par un bain de fixation, essentiel à la conservation des structures cellulaires. Le fixateur, de pH 7,47 contient une solution tampon de phosphate de sodium, 2 % de paraformaldéhyde, 1 % de caféine et 0,2 M de glutaraldéhyde à 25 % de grade II, avec de l’acide ascorbique à 0,8 % pour prévenir l'oxydation. La durée de fixation varie en fonction des échantillons (de 3 jours à 4 semaines). Un mouillant comme le Tween 20 peut être ajouté et un passage sous cloche à vide optimise l’infiltration.
L'étape suivante est la déshydratation, réalisée en immergeant les échantillons dans des solutions d’éthanol à concentrations croissantes (30° à 100°) à température ambiante. Chaque bain dure au moins une heure, avec un passage sous cloche à vide pour améliorer l'efficacité. Ensuite, un bain V/V d’éthanol et de butanol purs est effectué durant 1 à 5 jours avant l’imbibition en butanol 100°. Le temps de trempage dans ce dernier bain de butanol dure de quelques jours à un mois.
L'imprégnation se fait ensuite dans la résine Technovit® 7100, avec un bain de butanol pur et de résine (V/V) pendant 1 à 5 jours, suivi de deux bains successifs de résine pure pendant 1 à 2 mois afin d’assurer une meilleure pénétration dans les tissus.
Après l’imprégnation, les échantillons sont inclus dans un mélange de résine pure et de durcisseur Hardaner II, dans des proportions précises (7,5 mL de résine pour 0,5 mL de durcisseur). Le mélange est versé dans des moules en polyéthylène dans lesquels sont ajoutés les échantillons végétaux ou animaux. Les blocs polymérisent à température ambiante pendant une nuit (Figure 1a). Si la température est trop élevée, les moules sont placés sur un lit de glace pour ralentir le durcissement.
Une fois le mélange durci, un plot en PVC est collé sur le bloc (Figure 1b) pour faciliter le démoulage et maintenir l’échantillon lors de la coupe au microtome. Tous les échantillons sont étiquetés avec un scotch de couleur pour les différencier (Figure 1c)
Ce protocole permet d’obtenir des échantillons de qualité, essentiels pour réaliser des coupes microtomiques précises et analyser les structures végétales.

Figure 1. a) Plaques poly-éthylène, de 9 moules chacune, remplies du mélange résine/durcisseur dans lequel est déposé l’échantillon végétal. b) Plaque poly-éthylène avec les 9 moules recouverts des plots PVC. c) Échantillon fixé sur son plot et prêt à être coupé.
Technique de microtomie améliorée par application de vernis transparent
Une fois l’échantillon complètement préparé, il peut être découpé en sections à l'aide du microtome (Thermo Scientific, Microm HM 355S). L'épaisseur des coupes varie généralement entre 1 et 6 µm, bien que l'épaisseur optimale soit de 4 µm, permettant ainsi une visualisation détaillée des structures internes. Cependant, il arrive que certaines coupes puissent présenter des défauts. En effet, lors du passage du bloc de résine sur le couteau du microtome, les échantillons peuvent parfois se plier, se déchirer ou subir d'autres altérations mécaniques compromettant la qualité de la section.
Une technique innovante consiste à enduire la surface du bloc de résine avec un produit de type « vernis à ongles transparent » communément disponible en grandes surfaces. Cette méthode permet de surmonter plusieurs des difficultés rencontrées lors de la coupe au microtome. L’application du vernis agit comme un agent consolidant, stabilisant les différents organes et maintenant leur intégrité au sein de la résine tout au long du processus de coupe, ce qui évite leur déformation ou leur séparation. Afin de vérifier que le vernis n’altérait ni la structure des tissus ni les propriétés de coloration, des essais préalables ont été menés sur des échantillons dont l’organisation structurale était connue (fleurs de palmiers à huile).
L'application du vernis est réalisée à l’aide d’un pinceau fin (Figure 2a) en une couche uniforme sur la surface du bloc. Il est important de laisser sécher complètement le vernis avant de continuer. Le temps de séchage dépend de la température ambiante du laboratoire. La température ambiante idéale se situe entre 20 et 21 °C. Des températures plus élevées ou plus basses prolongent le temps de séchage sans toutefois altérer la qualité de la coupe.
Un simple passage du doigt à la surface du bloc permet de savoir si celle-ci est sèche. Dans ce cas, la coupe peut être réalisée (Figures 2b à 2f). Étant donné que le bloc de résine est enduit de vernis avant chaque coupe, il est recommandé de nettoyer régulièrement le couteau avec un sopalin imbibé d’éthanol 100° afin d’éviter que les sections ne collent au couteau du microtome.
Avant de commencer la coupe au microtome, il est essentiel de préparer un bain d’eau distillée chauffée à 60 °C, et de maintenir cette température constante tout au long du processus. Il est également conseillé de prévoir des instruments spécifiques, tels que des pointes métalliques et une pince d’horloger de type Dumont N° 5 pour manipuler les coupes avec précision.
Le bloc est fixé entre les mâchoires du microtome, et les paramètres de coupe sont ajustés avant de commencer les sections (épaisseur : 4 µm, mode : coupe par coupe, vitesse de coupe : variable en fonction du type de microtome et du manipulateur). Dans un premier temps, les coupes sont réalisées sans vernis jusqu’à l’obtention de l’organe recherché.
À partir de cette étape, malgré l’utilisation du vernis, il est impératif de vérifier l’intégrité des tissus sous microscope.
Si des replis sont observés, il est possible de déplier délicatement les sections sous l’objectif à l’aide d’une pointe métallique (EMS micro tools set hardened steel, nickel plated 0.8 mm by 25 mm long). Au cours de cette observation, si la coupe ne correspond pas aux attentes, celle-ci est jetée et l’opération recommencée.
Une fois la coupe retirée du microtome, la retourner soigneusement pour que la face recouverte de vernis soit en contact avec la plaque de verre (Figure 2g). Si les bords de la coupe présentent de légers replis, ceux-ci peuvent être délicatement éliminés à l’aide de la pointe métallique, tout en veillant à ce que la coupe repose correctement sur la paillasse (Figure 2h). Cette étape est essentielle, car elle prévient tout repliement excessif de la résine lors du contact avec l’eau chaude, et conditionne la réussite de la future coloration.

Figure 2. a) Application du vernis. b), c), d), e), f) Coupe de l’échantillon vernis. g), h) Étalement de la coupe sur la plaque de verre ou paillasse. i), j) Dépose de la coupe à la surface de l’eau chaude. k) Coupe flottant à la surface de l’eau.
Ensuite, toujours à l’aide de la même pince, la coupe est transférée dans l’eau chaude à 60 °C, avec la face vernie orientée vers le bas et l’échantillon vers le haut (Figures 2i, 2j). L’eau chaude permet à la coupe de s’étaler complètement (Figure 2k). Pour récupérer la coupe, il suffit de plonger une lame de microscopie dans le bain d’eau chaude (Figure 3a). À l’aide de la pointe métallique, la coupe est délicatement amenée et maintenue au contact de la lame de verre (Figure 3b). Cette dernière est ensuite soulevée verticalement (Figure 3c à 3h) pour observation au microscope, où la qualité de la coupe peut être évaluée (détection des rayures et des replis sur l’échantillon).
Après cette étape, la coupe déposée sur la lame de microscopie est séchée sur une plaque chauffante à 35° C. Une fois sèche, une rapide coloration au bleu de toluidine est effectuée en déposant une goutte de ce colorant sur la coupe en résine.

Figure 3. a), b), c) Mise en place de la première coupe sur la lame. d), e) Mise en place de la seconde coupe. f), g) Mise en place de la dernière coupe sur la lame. h) Sortie de la lame du bac d’eau chaude.
Le bleu de toluidine est utilisé pour colorer les différents éléments cellulaires. Dans notre cas, il nous permet également de vérifier l’orientation de la coupe par rapport à la couche de vernis.
Si la coupe est correctement positionnée et que le vernis est en contact avec la lame de verre, l’échantillon apparaîtra bleu sous le microscope. En revanche, si la coupe est mal orientée, le vernis empêchera la pénétration du colorant, et l’échantillon restera transparent, ce qui le rendra inutilisable pour l’observation et l’exploitation des résultats.
Trois vernis de marques différentes ont été testés. Bien qu’ils partagent une base commune, il en existe plusieurs types, du fait de l’ajout d’additifs. Ces additifs n’affectent en rien la préservation et la manipulation des coupes.
La base commune du vernis transparent est constituée de plusieurs ingrédients chimiques dont chacun contribue à ses propriétés de renforcement et de cohésion :
- La nitrocellulose, en tant qu'agent filmogène, forme une couche protectrice solide sur la surface de la coupe, réduisant les risques de déchirure.
- Les agents plastifiants permettent à la coupe de rester souple et résistante à l’étirement, facilitant ainsi sa manipulation et évitant les déformations, notamment lors de la récupération de la coupe sur le couteau du microtome.
- Le plastifiant thixotrope, quant à lui, ajuste la fluidité du vernis, ce qui est crucial pour une application uniforme.
- La résine confère à la coupe un aspect brillant et plastifié, idéal pour une observation détaillée.
- Les acétates, tels que l'acétate de butyle et l'acétate d’éthyle agissent principalement comme des solvants volatiles. Ils permettent une évaporation lente et uniforme du vernis, ce qui favorise la formation d’un film à la fois stable et cohésif. Ils facilitent la dissolution et la répartition uniforme de la nitrocellulose ce qui, indirectement, aide à renforcer la résistance du film, d’où une bonne cohésion et une solidité de la coupe.
Bien que la formule chimique ait évolué au fil des ans pour éliminer les agents toxiques, tels que le formaldéhyde ou le toluène, certains solvants présents dans le vernis demeurent potentiellement irritants. Il est donc essentiel de manipuler ces produits dans un environnement bien ventilé afin de limiter les risques d’exposition. Des recherches ont été effectuées afin de se procurer des substituts moins toxiques. Cependant, à ce jour, aucun produit alternatif n’a été identifié présentant des propriétés équivalentes (filmogène, souplesse, absence de déformation, résistance, uniformité et compatibilité avec la résine) et répondant aux exigences des applications histologiques.
Performance et limites de la technique : précautions à respecter
L’application de ce vernis transparent a prouvé son efficacité, permettant une amélioration notable de la qualité des coupes histologiques. En plus de renforcer la cohésion des échantillons, cette technique permet l’utilisation de colorants classiques sans compromettre l'intégrité des structures tissulaires. Toutefois, la technique a des limites. Le temps de séchage du vernis, qui dépend directement de la température ambiante, constitue un facteur de variabilité à prendre en compte. Bien que ce paramètre soit essentiel pour éviter des imperfections sur les coupes, la qualité finale des échantillons justifie largement cette contrainte. De plus, il est parfois préférable de privilégier la qualité de la coupe à la rapidité d'exécution, surtout dans le cadre de préparations d'échantillons délicats où la moindre déformation peut compromettre les résultats.
Il convient également de noter que la viscosité du vernis peut augmenter avec le temps, en particulier lors de son utilisation répétée. Cependant, ce problème peut être facilement corrigé en ajoutant quelques gouttes d’éthanol à 100°, ce qui permet de maintenir une viscosité adéquate pour une application homogène.
Il est important de veiller à ce que les coupes ne restent pas trop longtemps à la surface de l’eau chaude, car une exposition prolongée peut affecter la qualité des coupes. Pour garantir des résultats optimaux, il est conseillé d’adopter une approche minutieuse. La méthode recommandée consiste à poser délicatement la coupe à la surface de l’eau, puis à la récupérer immédiatement à l’aide d’une lame de microscopie. Une fois la coupe transférée sur la lame, il est important de la placer rapidement sur une plaque chauffante pour permettre un séchage uniforme. Cette technique assure que les coupes ne développent pas de déformations à cause de l’apparition de bulles, facilitant ainsi l’analyse précise lors des examens microscopiques.
Afin de garantir un processus optimal, certains paramètres doivent être scrupuleusement contrôlés. Parmi eux, la température de l’eau (maintenue à 60 °C pour une efficacité maximale lors de l'étalement des coupes), le séchage complet du vernis et le nettoyage régulier du couteau avec de l’éthanol 100°, pour éviter l’accumulation de résidus, qui pourrait entraîner des artefacts sur les coupes.
L’absence d’humidité ambiante est cruciale dans ce processus. En effet, dans un environnement humide, même après un séchage complet, les coupes ont tendance à se déformer, ce qui complique leur manipulation. Il devient alors difficile de les saisir et de les placer correctement sur une lame de verre, et encore plus sur la surface de l’eau. Cette condition est essentielle pour garantir une manipulation aisée et précise des échantillons.
Évaluation de la qualité des coupes histologiques
Depuis de nombreuses années, différentes coupes ont été réalisées sur diverses plantes, notamment les palmiers et le riz, ainsi que sur divers organes tels que les étamines, les carpelles, l’ovaire, l’embryon ou encore l’albumen (Buffard-Morel et al., 1992).
Les fleurs de palmiers présentent une organisation remarquable qui mérite d’être soulignée. Les inflorescences de palmiers sont composées de fleurs, elles-mêmes composées de sépales, de pétales, d’étamines et/ou de carpelles. Les jeunes stades de fleurs sont protégés par de petits organes nommés bractées. Ce sont des organes fins qui présentent une faible adhérence à la résine. Lors de la coupe, les bractées se détachent de l’épillet (Figure 4a). Les sépales et les pétales se détachent facilement de la résine par manque d’adhérence et se replient de manière désordonnée. Les étamines et les pistils sont les organes reproducteurs des fleurs. Ils sont encore plus fragiles en raison de leur taille et de leur finesse. En coupant les étamines, le pollen devient visible (Figure 5a), et en observant le pistil, on peut apercevoir l’ovaire. Tout comme le pollen, l’ovaire est une structure délicate qui se détache parfois complètement, laissant un trou au niveau de la fleur. Si l’adhérence de la résine aux différents organes est insuffisante, le tout se délite durant la coupe, et il arrive même que certaines fleurs soient perdues dans leur intégralité car arrachées de la loge où elles se trouvent.
Le collet des plantules de palmiers correspond à la zone de transition entre les racines et les pousses feuillées de la tige. Il est intéressant de noter qu’il se compose de trois parties distinctes, chacune jouant un rôle essentiel dans le développement de la plante. Le méristème foliaire est une structure clé car c’est de là que partent les primordia foliaires. Ces premiers stades de développement des feuilles sont cruciaux pour la croissance de la plante. Le méristème racinaire se situe également à ce niveau. Il est à l’origine des racines qui jouent un rôle vital dans l’ancrage de la plante au sol et dans l’absorption des nutriments et de l’eau. L’haustorium est un organe spécialisé qui agit comme un suçoir de l’albumen. L’albumen est un tissu nutritif qui alimente l’embryon. L’haustorium permet donc à la plantule d’accéder aux nutriments stockés dans les cellules de l’albumen. Or, sans vernis, toutes ces structures se séparent et s’abiment lors de la coupe (Figure 6a).
Concernant les nœuds de tiges de riz, les coupes présentant des primordia montrent également une fragilité, car le centre du nœud qui correspond à la moelle se casse facilement et les primordia sont souvent arrachés (Figure 7a).
Pour remédier à ces inconvénients, des essais ont été menés à l’aide de vernis transparent. Après de nombreux essais, la qualité des coupes s’est considérablement améliorée.
Les pétales et les sépales des fleurs mâles et femelles qui entourent et protègent les organes floraux restent solidement en place. Cette fixation adéquate permet de maintenir correctement l’ensemble de la fleur, garantissant ainsi son intégrité.
Les étamines conservent une position élancée (Figure 5b). Elles se trouvent soit juste au-dessus du gynécée - l’organe femelle de la fleur - soit fermement ancrées dans le calice.
Grâce à l’application de vernis lors de la coupe, les bractées sont désormais maintenues en place, permettant une présentation ordonnée des fleurs le long de l’épillet de l’inflorescence (Figure 4b). De plus, il est parfois possible d’observer des fleurs de stade juvénile émergeant délicatement à l’aisselle des bractées.
Les sections végétales peu épaisses restent bien individuellement définies. Les colorations à l’APS-NBB (Langeron, 1949), au bleu de toluidine, au DAPI ou au iodure de propidium (Manuel Technique d’Histologie et d’Imagerie Cellulaire – CIRAD) et au rouge de ruthénium sont fines, uniformes et propres, car la pénétration des colorants est facilitée par cette faible épaisseur de coupe. La cohésion entre les différents organes est maintenue. Par conséquent, lors de l’observation au microscope, les images obtenues sont fiables et d’une qualité avérée. Les exemples suivants démontrent l’amélioration des coupes apportées par l’application de vernis.
Coloration APS-NBB – br : bractées, fl : fleurs protégées par les bractées
Figure 4. a) Fleurs mâles de palmier Doum sans vernis, b) Fleurs mâles de palmier Doum avec vernis
Coloration bleu de toluidine – e : étamine, se : sépale, p : pollen, fi : filet
Figure 5. a) Étamines de palmier Chamaerops sans vernis, b) Étamines de palmier Chamaerops avec vernis
Grâce à l’application de vernis, toutes les structure du collet de plantules de palmiers, restent en place (Figure 6b). Le méristème foliaire restant en place, il est possible d’observer son développement ainsi que celui des feuilles. Le méristème racinaire reste en place et de ce fait, il est possible d’observer la racine primaire. Il en va de même pour l’haustorium. En résumé, l’efficacité de l’application de vernis sur les collets des plantules de palmiers ne doit pas être sous-estimée. Elle joue un rôle fondamental dans le renforcement de la cohésion au niveau des différents organes.
Coloration APS-NBB – f : feuille, mf : méristème foliaire, h : haustorium, rd : racine détachée, mr : méristème racinaire, r : racine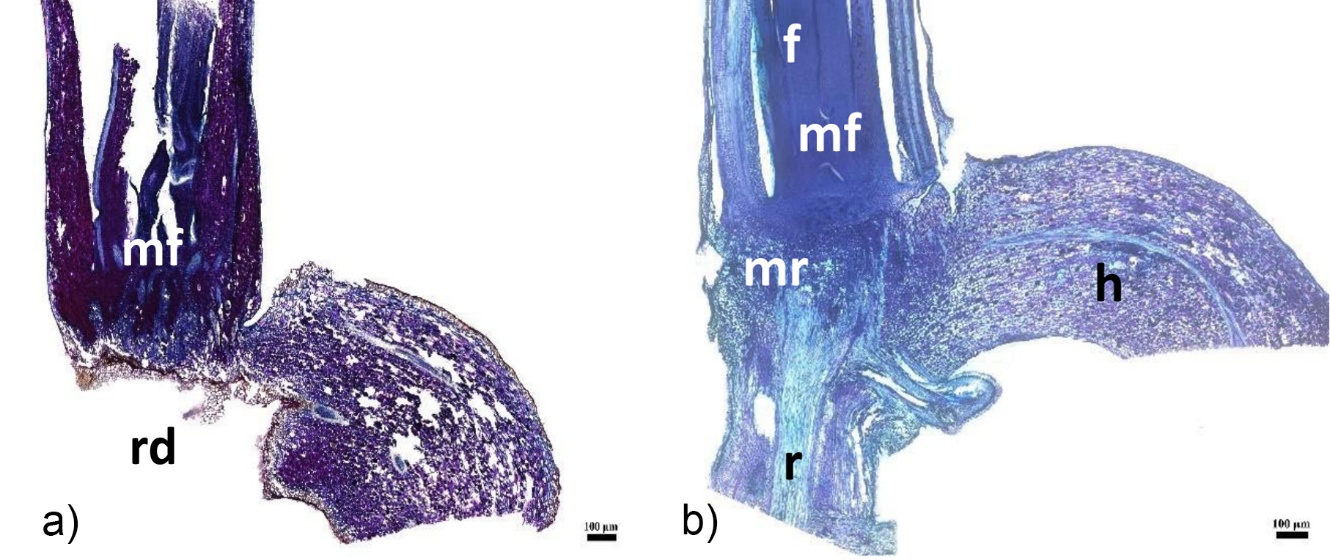
Figure 6. a) Collet de palmier à huile sans vernis, b) Collet de palmier à huile avec vernis
L’utilisation du vernis sur les blocs de résine contenant des échantillons de riz constitue une étape essentielle dans l’analyse morphologique de ces plantes. En protégeant les structures internes, ce traitement permet de conserver l’intégrité des tissus, en particulier au niveau des nœuds. Dans le cas observé, la moelle reste intacte lorsqu’elle est présente au niveau du nœud. Cela est particulièrement significatif, car la moelle est un tissu essentiel qui joue un rôle dans le transport et le stockage de nutriments.
Les primordia sont des structures embryonnaires qui se développent à partir de tissus méristématiques. Ils demeurent également bien préservés grâce à l’application du vernis. Cette préservation permet d’accéder à une analyse plus approfondie de leur architecture et de leur développement (Figure 7b).
Coloration APS-NBB – m : moelle, pr : primordia racinaires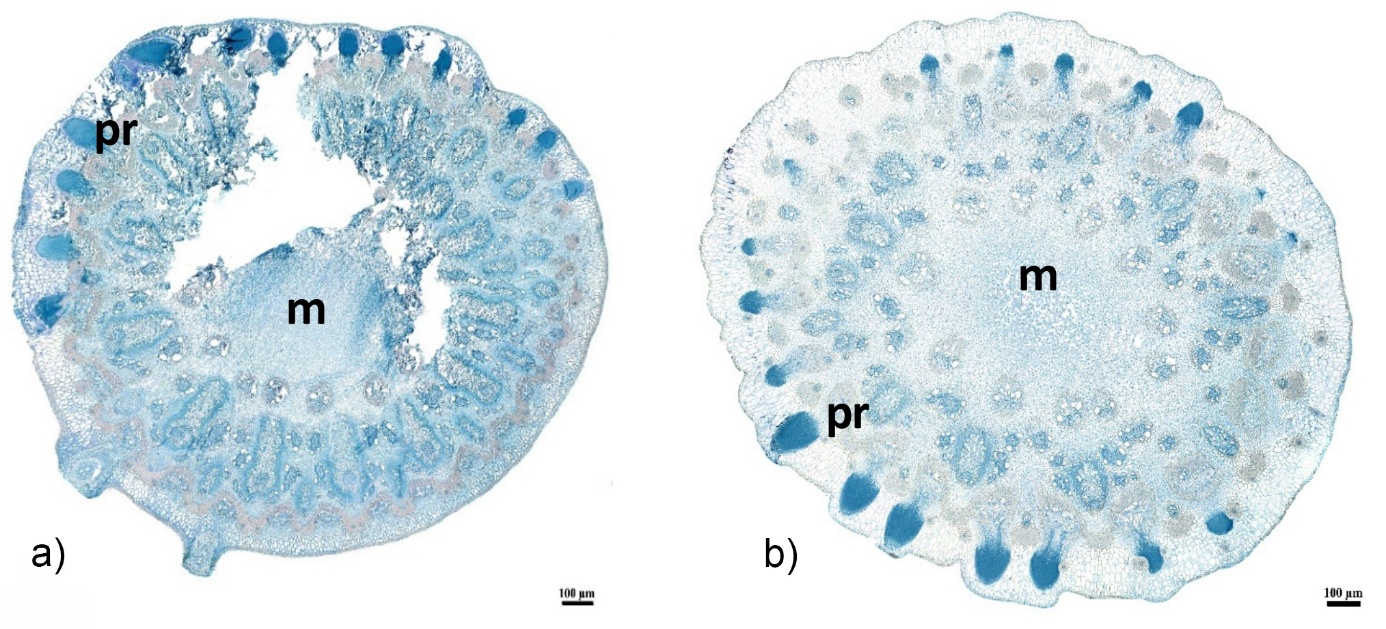
Figure 7. a) Nœud de riz avec primordia sans vernis, b) Nœud de riz avec primordia avec vernis
Lors de l’étape de coloration au rouge de ruthénium (Langeron, 1949) (Figure 8), il est intéressant de noter que toutes les coupes ont été réalisées en utilisant uniquement des échantillons traités avec du vernis. Cette approche ciblée garantit que les observations soient à la fois précises et reproductibles. Toutefois, il est important de souligner que lors de cette coloration, la moelle de certains nœuds n’était pas présente.
Coloration rouge de ruthénium – ma : moelle absente, pr : primordia racinaires.
Figure 8. Nœud de riz avec primordia enduit de vernis
L’utilisation de fluorochromes dans le domaine de la biologie végétale a gagné en intérêt ces dernières années, notamment pour la visualisation des structures cellulaires et de leur organisation.
L’utilisation des fluorochromes, tels que le DAPI (4’,6-diamidino-2-phénylindole) ou encore l’iodure de propidium, ont montré que ces techniques peuvent offrir des outils intéressants pour l’étude des tissus végétaux. L’intégration d’un vernis pourrait en outre améliorer l’efficacité de ces approches, ajoutant une nouvelle dimension à la microscopie fluorescente en biologie végétale. Ces travaux ouvrent la voie pour une meilleure visualisation des structures cellulaires.
Le DAPI permet de visualiser les noyaux cellulaires dans les échantillons végétaux. Nous avons utilisé du DAPI combiné à un agent antifading, tel que le Prolong® Gold Antifade Reagent, qui aide à stabiliser les signaux fluorescents, prolongeant ainsi la durée des observations au microscope.
L’iodure de propidium (Sigma), en revanche, est un colorant qui ne pénètre que dans les cellules dont les membranes sont compromises, ce qui en fait un excellent marqueur pour distinguer les cellules vivantes des cellules mortes. Cette caractéristique est particulièrement utile dans l’analyse des tissus comme ceux des fleurs de palmiers, car elle permet d’obtenir des informations sur l’intégrité cellulaire et l’état de santé des tissus examinés.
Dans toutes les expérimentations menées, un échantillon témoin non verni (Figures 9a et 10a) a été incorporé dans le protocole pour établir une base de comparaison fiable. Cela permet d’évaluer l’efficacité des fluorochromes en tant que marqueurs sans l’influence potentielle du vernis. Évaluer un échantillon témoin est crucial pour garantir l’exactitude des résultats, car cela permet d’éliminer les artefacts qui pourraient résulter d’un traitement non standardisé.
Les résultats des colorations avec le DAPI et l’iodure de propidium sur les fleurs de palmiers ont montré une fluorescence prononcée (Figures 9b et 10b). Il est, toutefois, intéressant de noter qu’une tendance a été observée. L’application de vernis, loin d’être un point négatif, semble plutôt renforcer la qualité de la coloration. Cette amélioration pourrait être attribuée à plusieurs facteurs :
- Stabilisation de la Fluorescence : Le vernis peut agir comme une barrière protectrice contre l’oxydation et d’autres facteurs environnementaux qui pourraient dégrader les fluorochromes et réduire leur intensité de fluorescence au fil du temps.
- Réduction des Artefacts : En immobilisant les échantillons, le vernis réduit les mouvements ou les déformations qui pourraient fausser les résultats d’observation, permettant ainsi une meilleure visualisation des structures cellulaires.
- Amélioration du Contraste : Un vernis peut améliorer le contraste de la fluorescence, rendant les structures cibles plus saillantes par rapport à l’arrière-plan.
Coloration DAPI – br : bractée, fl : fleurs protégées par les bractées
Figure 9. a) Fleurs mâles de palmier Doum sans vernis, b) Fleurs mâles de palmier Doum avec vernis
Coloration iodure de propidium – ra : rachis, fl : fleurs, br : bractées
Figure 10. a) Fleurs mâles de palmier Doum sans vernis, b) Fleurs mâles de palmier Doum avec vernis
Conclusion
La technique de vernis à ongles transparent s’est révélée extrêmement efficace pour préserver l’intégrité des échantillons lors de la coupe, surtout lorsque ces échantillons comprennent des tissus fragiles ou complexes. Par exemple, les organes floraux délicats, qui sont souvent sujets à des déformations ou à des ruptures lors du traitement, peuvent bénéficier de cette méthode. De même, les tiges et feuilles de riz ainsi que certains tissus peu denses retrouvent une stabilité cruciale pour obtenir des coupes fines et de qualité. Cette amélioration de la qualité des analyses histologiques permet de mieux examiner les structures cellulaires et tissulaires, favorisant ainsi des conclusions plus précises et pertinentes.
Pour optimiser encore davantage cette technique, il serait intéressant d’explorer l’utilisation d’autres fluorochromes, tels que les Alexa. Ces fluorochromes sont réputés pour leur capacité à se lier spécifiquement à certaines structures cellulaires, offrant une sensibilité élevée dans les études de microscopie à fluorescence. Leur utilisation pourrait considérablement enrichir l’analyse des échantillons traités avec du vernis, permettant de visualiser des caractéristiques subcellulaires précises qui ne seraient pas visibles autrement.
L’application de cette méthode à l’immunohistochimie (Fisher, 1968) pourrait vraiment transformer la manière dont nous étudions l’expression de protéines spécifiques dans les tissus végétaux. En combinant les propriétés de conservation du vernis avec les techniques d’immunomarquage, il serait peut-être possible de détecter des biomolécules tout en maintenant l’intégrité structurelle de l’échantillon. Cela ouvrirait de nouvelles perspectives pour étudier des processus biologiques complexes, tels que le développement, la réponse aux stress environnementaux ou les interactions entre différents types de cellules.
En conclusion, l’utilisation du vernis transparent a permis de surmonter de nombreux problèmes courants rencontrés lors de la coupe des échantillons végétaux fragiles. Cette méthode a fondamentalement amélioré la qualité des coupes microtomiques, garantissant une meilleure conservation de l’information anatomique. En rendant possible une analyse structurale plus précise, le vernis devient un outil précieux pour l’étude des tissus végétaux complexes. C’est pourquoi cette technique est désormais privilégiée au laboratoire, devenant la norme pour le traitement de ce type d’échantillons.
Voir plus …
Clark, G. (1981). Staining procedures. In Biological Stain Comission. ISBN 0683017071
Montes, F. (2007–2014). Manuel Technique d’Histologie et d’Imagerie Cellulaire – Plateforme PHIV. CIRAD. Contact : christelle.baptiste@cirad.fr
Références
- Buffard-Morel, J., Verdeil, J. L., & Pannetier, C. (1992). Embryogenèse somatique du cocotier (Cocos nucifera L.) à partir d’explants foliaires : étude histologique. Canadian Journal Of Botany, 70(4), 735 741. https://doi.org/10.1139/b92-094
- Fisher, D. B. (1968). Protein staining of ribboned epon sections for light microscopy. Histochemie, 16(1), 92 96. https://doi.org/10.1007/bf00306214
- Langeron, M. (1949). Précis de Microscopie : technique - expérimentation - diagnostic. Dans Collection de Précis Médicaux (7e édition). ISSN 2212-862X
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 272
Vues: 272
Téléchargements
 PDF: 41
PDF: 41
 XML: 6
XML: 6

