La Live-Box, un nouveau dispositif pour la mesure des cinétiques de transpiration à l’échelle plante entière
Résumé
Pour étudier la résistance de plantes à la sécheresse, il faudrait pouvoir surveiller en continu différents traits physiologiques dont la conductance foliaire résiduelle (ou transpiration résiduelle), trait fonctionnel majeur. Or, les méthodes existantes sont partielles et destructrices. Dans le cadre des travaux menés par l’équipe SUREAU, membre de l’unité PIAF (Physique et physiologie Intégratives de l’Arbre en environnement Fluctuant), nous avons développé un nouveau dispositif, la Live-Box, pour étudier la réponse de plantes intactes à différents niveaux contrôlés de sécheresse et de VPD (déficit de pression de vapeur). Il s’agit d’une boîte régulée en température et en humidité relative, faite maison, pouvant accueillir une plante entière. Cette plante est pesée en continu et suivie par différents capteurs permettant de mesurer des traits physiologiques liés à la sécheresse. Après avoir validé l’homogénéité et la stabilité du dispositif, nous présentons les résultats concernant la transpiration résiduelle de deux espèces : des plants de peuplier hydride (Populus tremula x Populus alba) et de laurier du Portugal (Prunus lusitanica) en pot. La Live-Box permet de détecter la fermeture stomatique et la conductance minimale sur une plante entière soumise à une sécheresse.
Glossaire
Conductance minimale foliaire (gmin) : correspond aux pertes en eau par transpiration une fois les stomates fermés, on l’appelle aussi transpiration résiduelle.
Stomates : pores à la surface des feuilles qui permettent les échanges gazeux entre la plante et l’atmosphère, des molécules d’eau sortent et des molécules de CO2 rentrent grâce à la photosynthèse.
Photosynthèse : consiste à transformer l’énergie lumineuse en énergie chimique, c’est-à-dire que l’énergie lumineuse est mise en réserve dans les liaisons chimiques d’un composé bien connu : le glucose. Ce phénomène s’accompagne de l’absorption de dioxyde de carbone (CO2) et de production d’oxygène (O2).
Potentiel hydrique : une grandeur physique qui décrit le statut hydrique d’une plante, c’est-à-dire, si elle est déshydratée ou non.
Psychromètre : permet de déterminer le potentiel hydrique d’une plante. Son principe est de mesurer l’humidité relative de l’air en équilibre avec l’humidité de la plante dans une chambre hermétique. Il est composé de deux thermocouples identiques fixés à un support.
Thermocouple : capteur servant à mesurer la température. Il se compose de deux métaux de natures différentes reliés à une extrémité. Quand la jonction des métaux est chauffée ou réfrigérée, une tension variable est produite, qui peut être ensuite transcrite en température.
Température de rosée : la température sous laquelle la rosée se dépose naturellement. En dessous de cette température, qui dépend de la pression et de l’humidité ambiantes, la vapeur d’eau contenue dans l’air se condense sur les surfaces par effet de saturation.
Cavitation : correspond à la formation d’une bulle d’air dans les vaisseaux des plantes (le xylème), qui vient rompre la colonne d’eau et rend ainsi l’appareil vasculaire impropre au transport de la sève.
VDP : déficit de pression de vapeur d’eau (en kPa) calculé avec la pression de vapeur saturante moins la pression partielle de vapeur de l’eau. Une estimation précise de ce VPD requiert une mesure de la température des feuilles, qui peut être légèrement différente de celle de l’air. Dans cette étude, la température foliaire est considérée identique à la température de l’air et la pression atmosphérique est récupérée sur une station météo présente sur le site de Crouel.
Défaillance hydraulique du xylème : peut conduire à une dégradation de l’état hydrique de la plante, une diminution de l’eau contenue dans ses tissus suite aux phénomènes de cavitation.
Xylème : tissu conducteur des plantes qui conduit la sève brute des racines vers les feuilles et qui constitue entre autres le bois des arbres. Il peut être comparé à une colonne remplie d’eau.
Conductance hydraulique : capacité d’un arbre à transporter de l’eau des racines aux feuilles.
Raspberry Pi : nano-ordinateur mono-carte à processeur ARM de la taille d’une carte de crédit et à faible coût.
Introduction
L’augmentation des vagues de chaleur et des événements de sécheresse, dus au réchauffement climatique, augmente les dépérissements des forêts à l’échelle mondiale (Hammond et al., 2022). Ces dépérissements sont liés à la rupture hydraulique causée par une forte demande en évaporation (VPD) et une pénurie d’eau (IPCC, 2023). La fermeture stomatique, qui intervient dans la phase précoce de déficit hydrique, permet temporairement aux arbres de limiter cette rupture hydraulique et de maintenir le potentiel hydrique au-dessus des valeurs seuil induisant la cavitation du xylème.
La conductance minimale foliaire (ou transpiration résiduelle) de la plante est un trait directement lié au taux de déshydratation de la plante et, par conséquent, au temps de défaillance hydraulique une fois les stomates fermés. Pour étudier la résistance de plantes à la sécheresse il faudrait pouvoir surveiller en continu différents traits physiologiques dont la conductance minimale foliaire. Or, les méthodes existantes sont partielles (on ne mesure que la conductance ou que la cavitation – exp. la Drought-Box (Cartailler et al., 2020) et destructrices (car on prélève des branches ou des feuilles). Par exemple, pour mesurer la résistance à la cavitation, il faut couper des branches, mais il est impossible de revenir en arrière et donc de voir la réhydratation de la plante.
À la demande d’une équipe de recherche, nous avons développé un nouveau dispositif, la Live-Box, pour étudier la réponse de plantes intactes à différents niveaux contrôlés de stress hydrique et de VPD en surveillant en continu différents traits physiologiques liés à la résistance des plantes à la sécheresse. La Live-Box est une boîte régulée en température et humidité relative faite maison, où l’on a la possibilité de mettre une plante entière. Cette plante est pesée en continu et suivie par différents capteurs pour mesurer ses traits physiologiques liés à la sécheresse.
Cet article présente ce dispositif, sa validation ainsi que les premiers résultats sur des plants de peuplier hydride (Populus tremula x Populus alba) et de laurier du Portugal (Prunus lusitanica) en pot.
Le dispositif
Le dispositif est composé d’une boîte hermétique constituée de plaques d’isolant (polystyrène extrudé) de 40 mm épaisseur (L = 800 mm, l = 850 mm, H = 1250 mm, soit un volume utile de 850 L), de trois résistances chauffantes (3 x 75 W) en bas au milieu et en haut de la boîte, un thermo-hygromètre (HyT271), plusieurs ventilateurs, un système de régulation de l’humidité relative (un compresseur, deux électrovannes, des tuyaux à air comprimé), un nano-ordinateur (Raspberry Pi), un microcontrôleur (Arduino) pour la régulation de température et de l’humidité relative et 10 lampes LED (Cree XLamp CXA3070) pilotées par l’Arduino pour simuler la variation de la lumière en fonction de la journée (Figures 1 et 2).
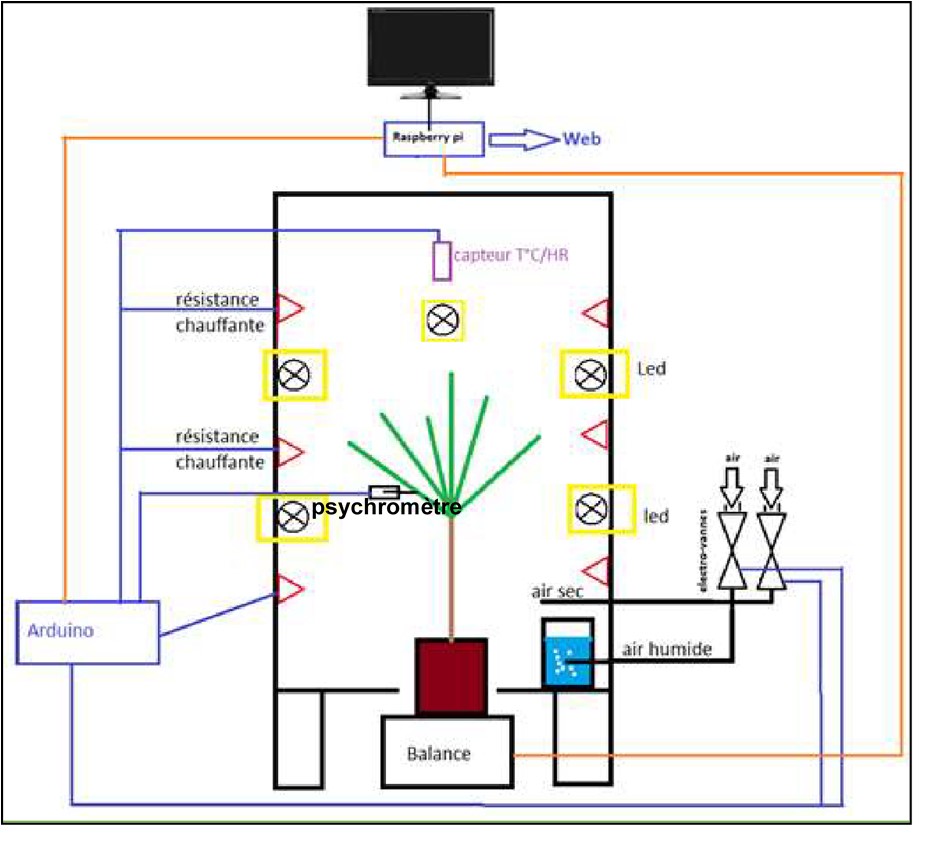

La Live-Box contient différents capteurs : une balance (Precisa LS6200C) pour suivre la perte de poids liée à la transpiration, des psychromètres automatiques (PSY1 Stem Psychrometer de ICT international) pour suivre le potentiel hydrique.
La balance est placée sous la box pour éviter les perturbations dues aux variations de température. La résolution de la balance est de l’ordre de 0,01 g, ce qui nous permet de bien mesurer la transpiration (de l’ordre de 1 g par heure pour la transpiration résiduelle de la plante entière). Le Raspberry Pi pilote tout le système et enregistre les données des capteurs (masse, température, humidité relative, déplacement). Le microcontrôleur Arduino effectue la régulation via un correcteur PID de la température et de l’humidité relative, la lecture du capteur température/humidité relative. La régulation d’humidité se fait avec l’air comprimé sec et une cartouche de desséchant pour diminuer la quantité d’eau dans l’air ou, au contraire, l’air comprimé passe dans un bulleur rempli d’eau pour augmenter la quantité d’eau dans l’air.
Les psychromètres mesurent le potentiel hydrique de la plante, c’est le témoin de son état de déshydratation. Le principe est le suivant : une chambre est positionnée sur une branche ou une feuille (Figure 2), qui contient deux microthermocouples. Le premier thermocouple mesure la température et la température de rosée de la chambre alors que le second mesure la température et la température de rosée au contact du xylème. À l’aide de ces quatre paramètres, le capteur calcule le potentiel hydrique.
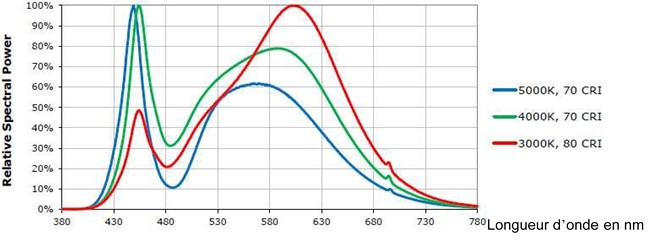
Des LED de deux types ont été installées : cinq de 4000 K et cinq de 3000 K, avec deux spectres différents (450 nm et 600 nm) pour maximiser les longueurs d’onde absorbées par les plantes (Figure 3).
La plage de fonctionnement de la Live-Box va de la température ambiante à +50 °C, avec une humidité relative de 10 % à 60 % et une teneur maximale en eau de 35 g d’eau/kg d’air sec. Son coût de fabrication est de l’ordre de 3000 €.
Validation
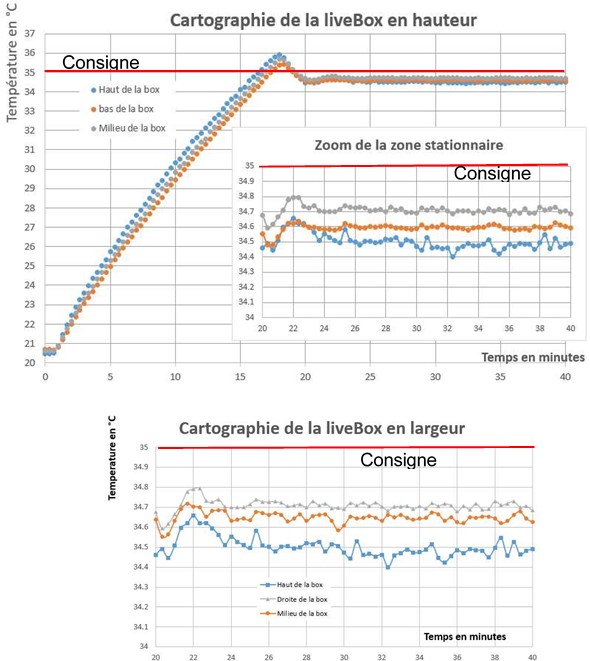
Nous avons validé le dispositif en vérifiant l’homogénéité de la box en température et lumière.
Le dispositif met une vingtaine de minutes pour atteindre la consigne en température et humidité relative et la stabilité est de l’ordre de 0,2 °C et 0,5 %, respectivement, et la différence de température dans l’enceinte est de 0,5 °C (Figure 4). Pour la lumière, on a une moyenne de 417 µmol.m-2.s-1 avec un écart type de 31 µmol. m-2.s-1. Si l’allumage des LED est partiel, on obtient une quantité de lumière de 217 µmol. m-2.s-1 et 233 µmol. m-2.s-1 (Tableau 1).
Position capteur | Bas droit | Milieu droit | Milieu centre | Milieu gauche | Haut droit |
Intensité lumineuse en µmol.m-2.s-1 avec toute les LED allumées |
461.5 |
404.6 |
428.3 |
410.5 |
301.4 |
Intensité lumineuse en µmol. m-2.s-1 avec la 1re moitié des LED |
216.8 | ||||
Intensité lumineuse en µmol. m-2.s-1 avec la 2e moitié des LED |
233.4 |
Exemples d’applications
Après validation technique, nous avons effectué les premières mesures sur des plantes entières. Les mesures ont été effectuées sur des plants de peuplier hydride (Populus tremula x Populus alba) et de laurier du Portugal (Prunus lusitanica) en pot.
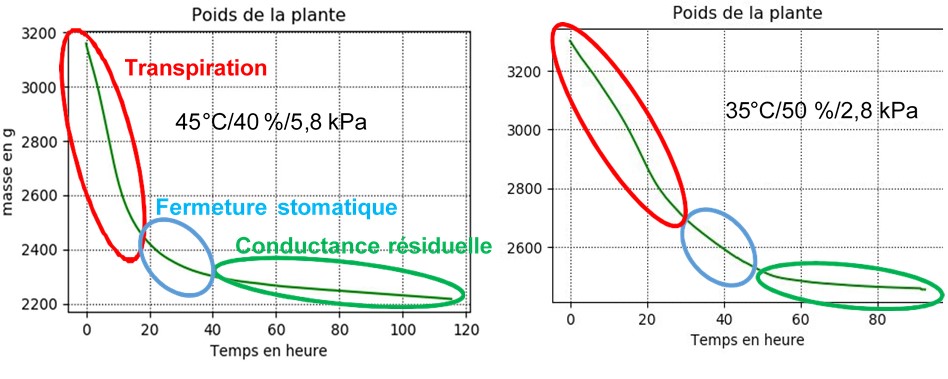
Nous avons exposé chaque plante en pot intacte à des conditions constantes de température. Au début des mesures, la plante était dans un état d’hydratation optimal, c’est-à-dire que son potentiel hydrique était proche de -0,5 MPa. L’objectif était de laisser la plante se déshydrater progressivement dans ces conditions afin d’essayer de déterminer sa transpiration, à quel moment la fermeture des stomates s’est produite et quelle était sa conductance résiduelle après la fermeture des stomates. Le pot était filmé pour éviter que le sol ne perde de l’eau par transpiration. Comme le montre la figure 5, nous pouvons facilement distinguer trois phases : une 1re phase linéaire avec une perte en eau rapide montrant que la plante a maintenu sa transpiration normale, une 2e phase d’inflexion correspondant au moment où la fermeture des stomates s’est produite et, enfin, une 3e phase linéaire à partir de laquelle les pertes d’eau de la plante se sont poursuivies de manière résiduelle. Ces valeurs ont été collectées à partir de la mesure continue du poids du pot dans lequel la plante était placée. Il est essentiel de connaître ces taux de perte d’eau résiduelle pour déterminer à quel moment les plantes peuvent atteindre des potentiels hydriques suffisamment bas pour provoquer une défaillance hydraulique du xylème de la plante et donc sa mort. Jusqu’à présent, la plupart des calculs de ces pertes d’eau résiduelles ont été effectués sur des segments de branches ou de feuilles individuelles, mais jamais au niveau de la plante entière.
Dans ce cas, notre objectif était, d’une part, de vérifier que notre système pouvait enregistrer les différences de pertes d’eau chez des plantes exposées à des conditions très différentes. D’autre part, d’un point de vue plus physiologique, il s’agissait d’évaluer comment le taux de perte d’eau des plantes pouvait être affecté par des épisodes environnementaux tels qu’une vague de chaleur. Les résultats obtenus ont été satisfaisants, car notre système a pu enregistrer de manière fiable les variations des taux de perte d’eau. Cela nous a permis de quantifier les changements induits par des conditions environnementales associées à des épisodes de haute température (45 °C et 40 % d’humidité relative, VPD de 5,8 kPa) en comparaison avec des conditions plus proches de celles enregistrées par ces plantes en été (35 °C et 50 % d’humidité relative, VPD de 2,8 kPa).
Les résultats sont les suivants (Figure 5) : avec un VPD de 5,8 kPa, la transpiration basale était de l’ordre de 40 g/h et la transpiration résiduelle de 1 g/h. En changeant le VPD (2,8 kPa), la transpiration basale était de 20 g/h alors que la résiduelle n’était pas modifiée. Pour normaliser la surface transpirée en fonction des différences de taille entre plants, toutes les feuilles ont été récupérées. Elles ont été séchées dans une étuve pendant au moins 72 heures à 70 °C, un temps suffisant pour les déshydrater complètement. Ensuite, nous avons mesuré le poids sec total des feuilles et, à partir d’une relation entre la surface foliaire des feuilles fraîches et leur poids sec (corrélation réalisée avant l’expérience), nous avons obtenu la surface transpirante de chaque individu. Cela nous a permis de normaliser la quantité d’eau perdue par chaque plante en fonction de sa surface foliaire totale.
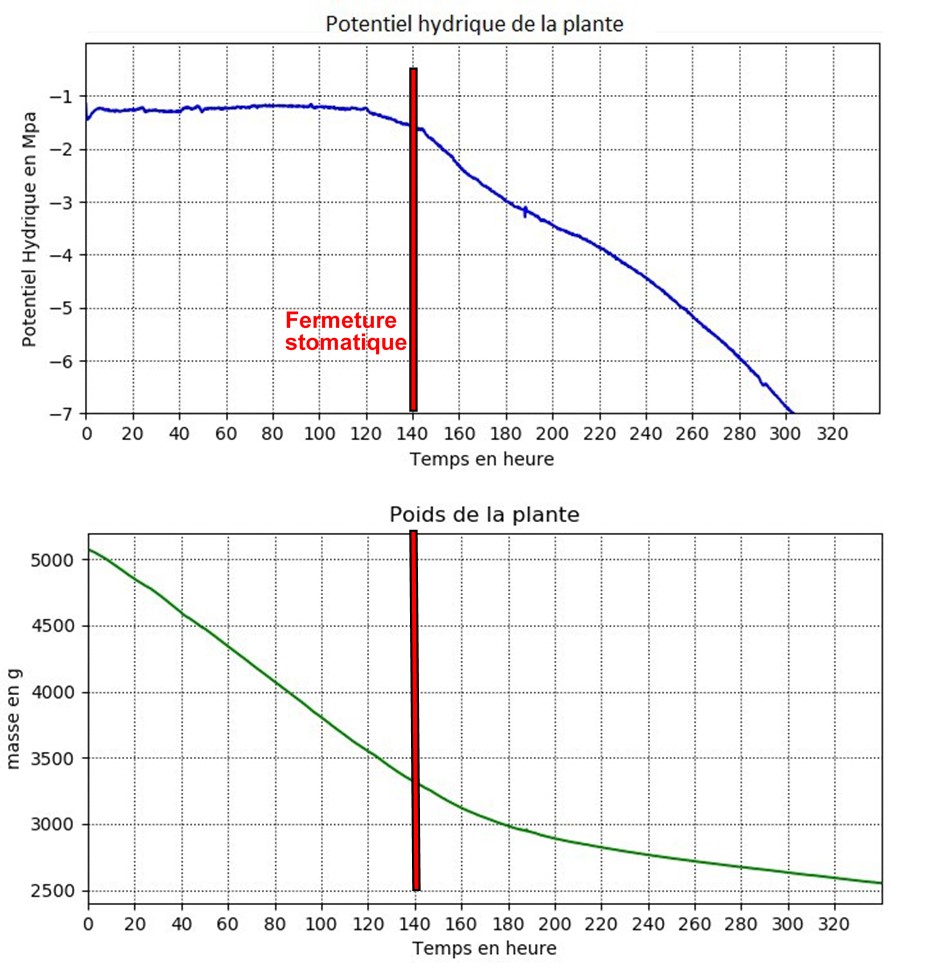
Pour les lauriers du Portugal (Prunus lusitanica), nous avons appliqué des conditions de 30 °C et 40 % qui correspondent à un VPD de 2,5 kPa. Nous avons comparé la dynamique de perte de poids avec le potentiel hydrique de la branche, le point de fermeture stomatique (Figure 6) est estimé en déterminant le point de courbure maximale sur la représentation de la perte de poids de la plante en fonction du temps. Concrètement, deux droites peuvent être tracées : l’une ajustée aux points obtenus lorsque les stomates sont ouverts (phase de transpiration), et l’autre correspondant à la phase où les stomates sont fermés (phase de conductance résiduelle). Le point d’intersection de ces deux droites représente une estimation du moment où la transition d’une phase à l’autre se produit et peut être interprété comme le moment où un plus grand nombre de stomates se ferment.
L’objectif de ces mesures est d’identifier à quels niveaux de stress hydrique (définis par les valeurs du potentiel hydrique) la plante ferme complètement ses stomates pour éviter les pertes d’eau par transpiration. Déterminer cette valeur est crucial, car à partir de ce point, la majeure partie des pertes d’eau de la plante se produit de manière résiduelle. Par conséquent, connaître ce niveau de stress est essentiel pour comprendre quand les pertes résiduelles (gmin) commencent à jouer un rôle important dans le risque de mort par dessèchement.
Conclusion et perspectives
La Live-Box permet de mesurer la conductance résiduelle de façon répétable.
Le dispositif a été utilisé pour l’instant sur deux espèces, mais il est appelé à servir à mesurer d’autres espèces à l’avenir.
Nous pourrons évaluer comment les plantes soumises à différentes conditions de sécheresse présentent des taux de déshydratation différents en fonction de leurs caractéristiques physiologiques. Le fait de pouvoir travailler avec des plantes intactes en pot nous permet également de prendre des mesures de réponse aux plantes non seulement pendant la phase de déshydratation en situation de stress, mais aussi pendant la phase de réhydratation pour évaluer la capacité de récupération de la plante.
Par ailleurs, la Live-Box permet d’accueillir d’autres capteurs utilisés par l’équipe SUREAU, tels que des dendromètres pour suivre l’évolution du diamètre de la branche, des cavicams pour suivre la cavitation dans les feuilles, mais aussi une caméra IR pour mesurer la température foliaire. Ces différents capteurs permettent d’obtenir une vision intégrée de la réponse des plantes à la sécheresse.
Références
- Cartailler, J., Billon, L., Cochard, H., Torres Ruiz, J. (2020). La Drought-Box, un nouvel outil pour mesurer les cinétiques de transpiration résiduelle des arbres. Le Cahier des techniques de l’INRA, 102(2), hal-03011739
- Hammond, W. M., Williams, A. P., Abatzoglou, J. T., Adams, H. D., Klein, T., López, R., Sáenz-Romero, C., Hartmann, H., Breshears, D. D., & Allen, C. D. (2022). Global field observations of tree die-off reveal hotter-drought fingerprint for Earth’s forests. Nature Communications, 13(1). https://doi.org/10.1038/s41467-022-29289-2
- IPCC (2023). Climate Change 2022 – Impacts, Adaptation and Vulnerability. https://doi.org/10.1017/9781009325844
Pièces jointes
Pas de document complémentaire pour cet articleStatistiques de l'article
 Vues: 490
Vues: 490
Téléchargements
 PDF: 117
PDF: 117

